
【题目】有机物 ①CH2OH(CHOH)4CHO、②CH3CH2CH2OH、③CH2=CH—CH2OH、④CH2=CH—COOCH3、⑤CH2=CH—COOH中,既能发生加成反应和酯化反应,又能发生氧化反应的是 ( )
A.③⑤B.①③⑤C.②④D.①③
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知M2O7x- + 3 S2- + 14 H+ = 2 M 3+ + 3S ↓ + 7H2O,则M2O7x-中的M的化合价为( )
A. +2 B. +3 C. +4 D. +6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4Al2(SO4)32Al2O36H2O,还含有杂质Fe2O3 . 利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示. 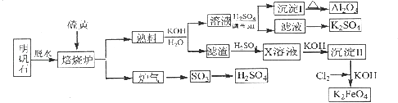
请回答下列问题:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4) ![]() 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3 , 转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3 , 转移的电子数目为 .
(2)生成沉淀I的离子方程式为 , 沉淀II的化学式为 .
(3)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀I,证明沉淀I已洗涤干净的实验操作和现象是
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式: .
(5)从滤液中得到K2SO4晶体的方法是 .
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
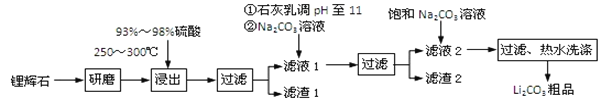
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于沉淀溶解平衡的说法中不正确的是( )
A.难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡
B.Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关
C.Ksp反映了物质在水中的溶解能力,可直接根据Ksp的数值大小比较电解质在水中的溶解能力大小
D.Ksp改变,可使沉淀溶解平衡移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
A. ①④⑤⑥ B. ①③④⑥ C. ①②③⑤ D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能加快反应速率的主要原因是( )
A.活化分子能量明显增加B.增加了活化分子的百分数
C.降低了反应所需的能量D.改变了反应物的本身性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com