
25℃、101kPa下:
①2Na(s)+1/2O2(g)=Na2O(s)△H1= -414k/mol
②2Na(s)+O2(g)=Na2O2(s)△H2=-511kJ/mol
下列说法正确的是 ( )
A.①和②生成等物质的量的产物,转移的电子数相同
B.Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
C.
D.①和②产物中的阴阳离子个数比均为1:1
科目:高中化学 来源: 题型:
已知反应:①101 kPa时,2C(s)+O2(g)====2CO(g);ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-====(aq)H2O(l);ΔH=-57.3 kJ·mol-1
下列结论正确的是 ( )
A.碳的燃烧热大于110.5 kJ·mol-1
B.①的反应热为221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如图: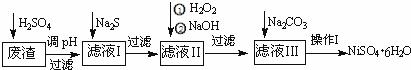
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 :
(2)加6%的H2O2时,温度不能过高,其目的是
(3)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀.在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为
(4)上述流程中滤液Ⅲ的主要成分是
(5)操作Ⅰ包括以下过程:过滤,溶解, , ,洗涤获得NiSO4•6H2O晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
选用正确的试剂和分离方法,除去下列物质中所含少量杂质(括号内为杂质):
例: 乙醇(水)生石灰,蒸馏
(1)苯(苯酚) ;(2)甲烷(乙烯) ;(3)乙酸乙酯(乙酸) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA 代表阿伏加德罗常数的数值,下列说法正确的是( )
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.标准状况下,NA个SO3分子所占的体积约为22.4 L
C.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+
D.标准状况下,22.4L Cl2与足量氢氧化钠溶液反应转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
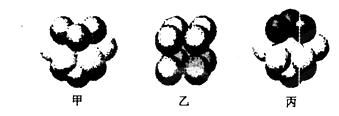
查看答案和解析>>
科目:高中化学 来源: 题型:
反应 2A(g) + B(g)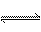 2C(g);△H > 0 。下列反应有利于生成C的是( )
2C(g);△H > 0 。下列反应有利于生成C的是( )
A. 低温、低压 B. 低温、高压 C. 高温、高压 D. 高温、低压
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。(写出计算过程)
N2O4(g)的平衡常数K。(写出计算过程)
(2)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到上述平衡时的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
在托盘天平右盘上放一个盛有100mL3mol•L﹣1NaOH溶液的烧杯,左盘上放一个盛有100mL3mol•L﹣1盐酸的烧杯,调节天平至平衡,然后在两烧杯中各加入等质量的铝片,反应完全后,则天平可能出现的情况是( )
|
| A. | 左盘下沉 | B. | 右盘下沉 | C. | 仍保持平衡 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com