
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
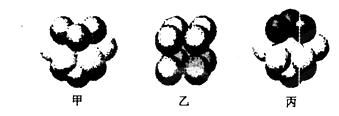
【知识点】物质结构与元素周期律 E4 E2 E3 N1 N3 N4
【答案解析】(1)O>C >Si (2分)
(2)< (2分)
(3)第五 (2分)
(4)C2H4,(2分)
 (5) (2分) 丙(2分)
(5) (2分) 丙(2分)  g/cm3(3分)
g/cm3(3分)
解析:(1)根据X的最外层电子数是其内层电子数的2倍知X是C,X、Y同周期,X与Y形成的常见化合物之一常被用于高炉炼铁推出Y是O,Z与X同主族,则Z是Si,W是Cu元素,X,Y,Z三种元素的非金属性由强到弱的顺序为O>C >Si。(2)由于O元素的电负性大于C元素,因此键的极性C-H < O-H(3)Si的最外层电子数为4,因此第五个电子失去会出现电离能突增。(4)C原子以sp2方式杂化,则应该形成碳碳双键,所以最小分子式为C2H4, (5)Cu的价电子排布3d104s1,其晶体中微粒的堆积方式为面心立方最密堆积,选择丙。用均摊法推知面心立方最密堆积Cu晶体中一个晶胞含有4个Cu原子,则一个晶胞的质量是4×64/NA,一个晶胞的体积是a3cm3,因此其密度为 g/cm3。
g/cm3。
【思路点拨】根据元素的性质、原子结构特点找出元素推断的突破口;根据元素周期律进行解答;有关晶胞的计算往往涉及均摊法:(1)处于顶点的粒子,同时为8个晶胞所共有,每个粒子有1/8属于该晶胞(2)处于棱上的粒子,同时为4个晶胞共有,每个粒子有1/4属于该晶胞(3)处于面上的粒子,同时为2个晶胞共有,每个粒子有1/2属于该晶胞(4)处于晶胞内部的粒子,则完全属于该晶胞。


科目:高中化学 来源: 题型:
在2A+B 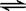 3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) = 0.3 mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)= 1 mol·L-1·S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能
对二者进行鉴别的是
A.利用质谱法 B.利用金属钠
C.利用红外光谱法 D.利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A仅含C、H、O元素,为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1 NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
| 实验步骤 | 实验结论 |
| (1)A的质谱图如下:
| (1)证明A的相对分子质量为:__________。 |
| (2)将此4.5 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重2.7g和6.6g。 | (2)证明A的分子式为: ________________。 |
| (3)另取两份4.5 g A分置于不同的试管中。 往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入_________________________________。 | (3)证明A的分子中含有一个羧基和一个羟基。 |
| (4)A的核磁共振氢谱如下图:
| (4)A的结构简式为: _________________________。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃、101kPa下:
①2Na(s)+1/2O2(g)=Na2O(s)△H1= -414k/mol
②2Na(s)+O2(g)=Na2O2(s)△H2=-511kJ/mol
下列说法正确的是 ( )
A.①和②生成等物质的量的产物,转移的电子数相同
B.Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
C.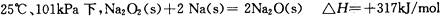
D.①和②产物中的阴阳离子个数比均为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应( )
X(g)+Y(g)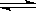 Z(g)+W(s);ΔH>0下列叙述正确的是
Z(g)+W(s);ΔH>0下列叙述正确的是
A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的ΔH增大
D.平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
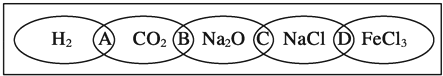
(1)请将分类依据代号填入相应的括号内:
A 两种物质都不是电解质 C 两种物质都是钠的化合物 B 两种物质都是氧化物 D 两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色.反应的离子方程式为 Fe3++3H2O═Fe(OH)3(胶体)+3H+ 向制备好的分散系中逐滴加入硫酸能看到什么现象是: 先沉淀后溶解
(3)纳米是长度单位,1纳米等于 10﹣9 米,纳米科学与纳米技术是研究结构尺寸在l~100nm范同内材料的性质与应用.
(4)现有一含有FeCl2和FeCl3的混合物样品,采经测定已知n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为 10% .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com