
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
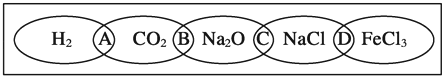
(1)请将分类依据代号填入相应的括号内:
A 两种物质都不是电解质 C 两种物质都是钠的化合物 B 两种物质都是氧化物 D 两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色.反应的离子方程式为 Fe3++3H2O═Fe(OH)3(胶体)+3H+ 向制备好的分散系中逐滴加入硫酸能看到什么现象是: 先沉淀后溶解
(3)纳米是长度单位,1纳米等于 10﹣9 米,纳米科学与纳米技术是研究结构尺寸在l~100nm范同内材料的性质与应用.
(4)现有一含有FeCl2和FeCl3的混合物样品,采经测定已知n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为 10% .
| 酸、碱、盐、氧化物的概念及其相互联系;电解质与非电解质.. | |
| 专题: | 物质的分类专题. |
| 分析: | (1)①电解质是在水溶液中或熔融状态下能导电的化合物,常见的电解质包括酸、碱、盐、金属氧化物、水等; ②化合物是由不同种元素组成的纯净物,钠的化合物即化合物中含有钠元素; ③氧化物是指只含有两种元素,且其中一种元素是氧元素的化合物; ④由金属离子(或铵根离子)和酸根离子组成的化合物属于盐; (2)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;胶体具有聚沉性质,加入硫酸先聚沉后溶解; (3)1纳米等于10﹣9m; (4)依据元素守恒计算氯化亚铁和氯化铁物质的量之比,进一步计算氯化铁质量分数. |
| 解答: | 解:(1)常见的电解质包括酸、碱、盐、金属氧化物、水,所以氢气、二氧化碳不是电解质,故选:A; 氧化钠和氯化钠都是化合物,且都含有钠元素,是钠的化合物,故选:C; 氧化钠和二氧化碳都是氧化物,故选:B; 氯化钠和氯化铁都是盐,故选:D; (2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色.反应的化学方程式为:FeCl3+3H2O 故答案为:FeCl3+3H2O (3)纳米是长度单位,1纳米等于10﹣9m,故答案为:10﹣9; (4)FeCl2和FeCl3的混合物的样品中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.1,得到x:y=9:1,氯化铁物质的量分数= 故答案为:10%. |
| 点评: | 本题考查学生阅读题目获取信息的能力,物质分类的方法,胶体制备,胶体性质的分析应用,混合物质量分数计算,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力.注意基础知识的全面掌握. |


科目:高中化学 来源: 题型:
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
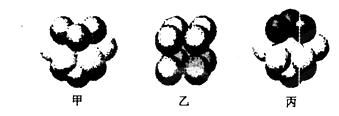
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的钠、镁、铝分别与足量稀盐酸反应,在同温同压下放出H2的体积比为( )
|
| A. | 1:2:3 | B. | 1:1:1 | C. | 3:2:1 | D. | 2:3:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是( )
①KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O;5:1
②Fe2O3+2Al Al2O3+2Fe;1:2
Al2O3+2Fe;1:2
③4HC1(浓)+MnO2 MnC12+C12↑+2H2O;1:2
MnC12+C12↑+2H2O;1:2
④3NO2+H2O═2HNO3+NO;2:1.
|
| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在托盘天平右盘上放一个盛有100mL3mol•L﹣1NaOH溶液的烧杯,左盘上放一个盛有100mL3mol•L﹣1盐酸的烧杯,调节天平至平衡,然后在两烧杯中各加入等质量的铝片,反应完全后,则天平可能出现的情况是( )
|
| A. | 左盘下沉 | B. | 右盘下沉 | C. | 仍保持平衡 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是
A.反应热指的是反应过程中吸收或放出的热量 B.原电池的负极发生氧化反应
C.伴随能量变化的不一定是化学变化 D.电解池的阳极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
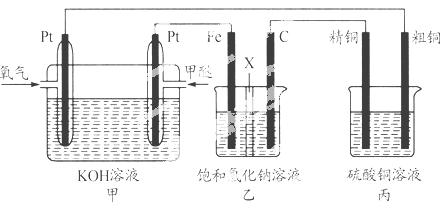
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式_______________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为______ ___ __,反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的标况下的体积为____ ____;丙装置中阴极析出铜的质量为____ ___ _。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
A.2.7 g金属铝变为铝离子时失去的电子数为0.1NA
B.任何条件下,16gCH4与18 g H2O所含有电子数均为10NA
C.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等
D.22.4 L的CO气体与1 mol N2所含的电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com