
如下图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
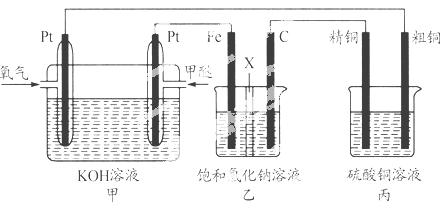
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式_______________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为______ ___ __,反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的标况下的体积为____ ____;丙装置中阴极析出铜的质量为____ ___ _。

科目:高中化学 来源: 题型:
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
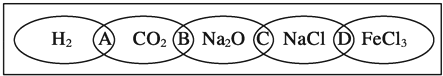
(1)请将分类依据代号填入相应的括号内:
A 两种物质都不是电解质 C 两种物质都是钠的化合物 B 两种物质都是氧化物 D 两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色.反应的离子方程式为 Fe3++3H2O═Fe(OH)3(胶体)+3H+ 向制备好的分散系中逐滴加入硫酸能看到什么现象是: 先沉淀后溶解
(3)纳米是长度单位,1纳米等于 10﹣9 米,纳米科学与纳米技术是研究结构尺寸在l~100nm范同内材料的性质与应用.
(4)现有一含有FeCl2和FeCl3的混合物样品,采经测定已知n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为 10% .
查看答案和解析>>
科目:高中化学 来源: 题型:
反应 A+B →C(△H <0)分两步进行 ① A+B→X (△H >0) ② X→C(△H <0)下列示意图中,能正确表示总反应过程中能量变化的是
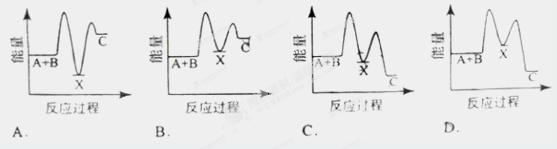
查看答案和解析>>
科目:高中化学 来源: 题型:
美国一个海军航空站安装了一台250 kW的MCFC型燃料电池。该电池可同时供应电和蒸汽,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~800 ℃。已知该电池的总反应为2H2+O2 2H2O,负极反应为H2+CO32--2e-
2H2O,负极反应为H2+CO32--2e- H2O+CO2。下列推断正确的是
H2O+CO2。下列推断正确的是
A.正极反应为4OH--4e- O2↑+2H2O B.放电时, CO32-向负极移动
O2↑+2H2O B.放电时, CO32-向负极移动
C.电池供应1 mol水蒸气,转移的电子的物质的量为4 mol D.放电时CO32-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子或分子组中大量共存且满足相应要求的是
A.K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液
B.Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体
C.Na+、K+、Ag+,NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失
D.NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填序号)。
a.离子键 b.共价键 c.配位键
d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③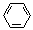 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
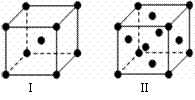 (4)金属C、F晶体的晶胞结构如右图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 。
(4)金属C、F晶体的晶胞结构如右图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
B.NH4HCO3(s) NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com