
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填序号)。
a.离子键 b.共价键 c.配位键
d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③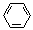 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
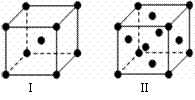 (4)金属C、F晶体的晶胞结构如右图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 。
(4)金属C、F晶体的晶胞结构如右图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 。
【知识点】物质结构、化学键、核外电子排布、晶胞计算
【答案解析】(1)K ,N (2)K4[Fe(CN)6] ,2NA个, def
(3)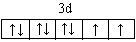 ,①③④ ,平面三角,加成产物CH3OH分子之间能形氢键
,①③④ ,平面三角,加成产物CH3OH分子之间能形氢键
(4)2:3 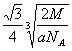
解析:A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,A是形成化合物种类最多的元素,则A为碳元素;A、B属于同一短周期元素且相邻,则B为氮元素;C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,则C是钾元素,其价层电子排布为4S1;F是铜元素,其价层电子排布为3d104S1;基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,则D是铁元素,其价层电子排布为3d64S2;E为镍元素,其价层电子排布为3d84S2;(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,所以,六种元素中第一电离能最小的是K,元素周期表从左到右,元素的电负逐渐增大,从上到下,电负性逐渐变小,所以,电负性最大的是N;(2)根据信息直接写出黄血盐的化学式:K4[Fe(CN)6]; AB-是CN-,根据C≡N结构,1molCN-中含有2molπ键,即2NA个。黄血盐晶体中各种微粒间的作用力有离子间的离子键、非金属原子间的共价键、铁与氰跟的配位键,没有金属键、氢键 、分子间的作用力。
E2+是Ni2+,价层电子排布图为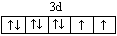 ;CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化;CH≡CH中含有1个σ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化;苯中碳原子成1个C-Hσ键,2个C-C σ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化;HCHO中碳原子成2个C-Hσ键,1个碳氧双键,双键中含有1个σ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,未容纳孤对电子对,全部成σ键,参与成键的原子不同,所以HCHO为平面三角形;它加成产物是甲醛,氧原子的电负性大,与氢原子间形成氢键,所以熔、沸点比CH4的熔、沸点高;
;CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化;CH≡CH中含有1个σ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化;苯中碳原子成1个C-Hσ键,2个C-C σ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化;HCHO中碳原子成2个C-Hσ键,1个碳氧双键,双键中含有1个σ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,未容纳孤对电子对,全部成σ键,参与成键的原子不同,所以HCHO为平面三角形;它加成产物是甲醛,氧原子的电负性大,与氢原子间形成氢键,所以熔、沸点比CH4的熔、沸点高;
(4)Ⅰ是钾晶胞,配位数是8,Ⅱ是铜晶胞,配位数是12,两种晶体晶胞中金属原子的配位数之比为2:3 。此晶胞含2个钾原子,,先求出晶胞的体积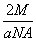 ,再算出棱长,最后体对角线是4倍的原子半径,则原子半径的计算式为
,再算出棱长,最后体对角线是4倍的原子半径,则原子半径的计算式为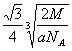
【思路点拨】本题涉及原子结构、分子空间构型的判断、杂化方式的判断、第一电离能的判断并涉及晶胞的计算等知识点,这些都是考试热点,注意第一电离能的变化趋势,为易错点。


科目:高中化学 来源: 题型:
等物质的量的钠、镁、铝分别与足量稀盐酸反应,在同温同压下放出H2的体积比为( )
|
| A. | 1:2:3 | B. | 1:1:1 | C. | 3:2:1 | D. | 2:3:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
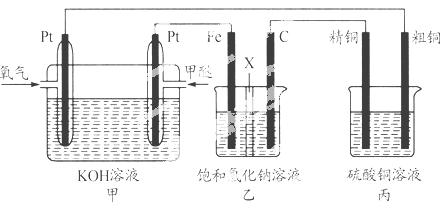
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式_______________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为______ ___ __,反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的标况下的体积为____ ____;丙装置中阴极析出铜的质量为____ ___ _。

查看答案和解析>>
科目:高中化学 来源: 题型:
在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A.0.225mol/L B.0.30mol/L C.0.36mol/L D.0.45mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其解释不正确的是( )
A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某化学学习小组用来探究钠与水反应的实验装置。该装置可以集反应、收集、检验气体于一体。图中钠块是用大头针叉住的。请填空:
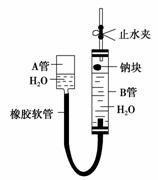
(1)钠块的位置靠近B管上的胶塞,为了尽可能收集到纯净的气体,应先________(填“打开”或“关闭”)止水夹,然后慢慢提升A管,待B管中钠块与水接触时,应立即________(填“打开”或“关闭”)止水夹,所以A管的作用是________
________________________________________________________________________。
(2)钠与水反应的化学方程式是__________________________________________。
(3)为了安全,钠与水反应产生的气体在点燃前应该__________,而该方法中可以直接点燃这种气体,其原因是______________________点燃该实验中产生的气体的操作方法是先用明火靠近导气管口,然后打开止水夹,可以观察到气体的燃烧,该气体燃烧的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
A.2.7 g金属铝变为铝离子时失去的电子数为0.1NA
B.任何条件下,16gCH4与18 g H2O所含有电子数均为10NA
C.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等
D.22.4 L的CO气体与1 mol N2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,已知某溶液中由水电离出的c(H+)和c(OH-)浓度的乘积为10-24,则在该溶液中,一定不能大量存在的离子是
A.SO32- B. HCO3- C.NH4+ D.NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com