
在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A.0.225mol/L B.0.30mol/L C.0.36mol/L D.0.45mol/L
【知识点】有关混合物的有关计算
【答案解析】C 解析:反应离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO(g)+4H2O,铜足量,由上述反应方程式可知,NO3-和H+的物质的量之比为1:4,氢离子与硝酸根恰好反应,生成的铜离子物质的量最大,设HNO3、H2SO4各为x、ymol,则n(NO3-):n(H+)=x:(x+2y)=1:4,x+y=0.6×0.1,联立解得x=0.024mol、y=0.036mol,由方程式可知,生成铜离子的物质的量为0.024mol× 3/2=0.036mol,故铜离子的最大浓度为0.36mol/L
故答案选C
【思路点拨】本题考查化合物的有关计算,确定NO3-和H+的物质的量之比为1:4时生成的铜离子浓度最大是解题的关键,难度中等,注意利用离子方程式进行解答。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
无机化合物可根据其组成和性质进行分类,如下所示:
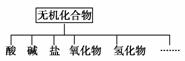
(1)上面所示的物质分类方法名称是________。
(2)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②____ | ③______④Ba(OH)2 | ⑤Na2CO3⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面。
(3)写出⑦转化为⑤的化学方程式___________________________________________
________________________________________________________________________。
(4)写出实验室由⑩制备O2的化学方程式_____________________________________
________________________________________________________________________。
(5)实验室制备⑦常用________和________反应,检验该气体的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化中,属于放热反应的是
A.H2O(g)==H2O(l) △H= -44kJ/mol
B.2HI(g)==H2(g)+I2(g) △H=+14.9kJ/mol
C.能量变化如右图所示的化学反应
D.形成化学键时放出能量的化学反应
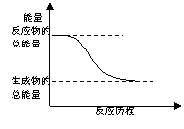
查看答案和解析>>
科目:高中化学 来源: 题型:
美国一个海军航空站安装了一台250 kW的MCFC型燃料电池。该电池可同时供应电和蒸汽,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~800 ℃。已知该电池的总反应为2H2+O2 2H2O,负极反应为H2+CO32--2e-
2H2O,负极反应为H2+CO32--2e- H2O+CO2。下列推断正确的是
H2O+CO2。下列推断正确的是
A.正极反应为4OH--4e- O2↑+2H2O B.放电时, CO32-向负极移动
O2↑+2H2O B.放电时, CO32-向负极移动
C.电池供应1 mol水蒸气,转移的电子的物质的量为4 mol D.放电时CO32-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜
B.标准状况下,33.6 L三氧化硫中含有1.5 NA个三氧化硫分子
C.1mol Cl2与过量的铁反应,转移3NA个电子
D.1 mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填序号)。
a.离子键 b.共价键 c.配位键
d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③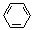 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
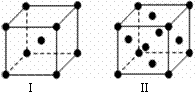 (4)金属C、F晶体的晶胞结构如右图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 。
(4)金属C、F晶体的晶胞结构如右图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Na2CO3和NaHCO3性质的说法错误的是( )
A.热稳定性:NaHCO3<Na2CO3
B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3
C.相同温度时,在水中的溶解性:NaHCO3<Na2CO3
D.等物质的量浓度溶液的pH:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比是8:1:2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是( )
A.1:1:1 B.1:4:2 C.1:2:4 D.1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
CO是对环境影响较大的气体,对它的合理控制和治理是优化我们生存环境的有效途径。
(1)工业上用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
① 2H2(g)+CO(g)+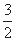 O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:___________。
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+CO(g)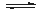 CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的
CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的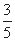 ,据此计算该温度下反应的平衡常数(写过程)。
,据此计算该温度下反应的平衡常数(写过程)。
(3)在恒温恒容的条件下,向(2)达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡 。
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断是否移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com