
下列离子或分子组中大量共存且满足相应要求的是
A.K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液
B.Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体
C.Na+、K+、Ag+,NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失
D.NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
图中“—”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )
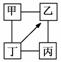
| 甲 | 乙 | 丙 | 丁 | |
| A | H2SO4 | Na2SO4 | NaOH | NaCl |
| B | KCl | K2CO3 | KOH | HCl |
| C | O2 | CO | CuO | C |
| D | Fe | CuCl2 | Zn | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是
A.反应热指的是反应过程中吸收或放出的热量 B.原电池的负极发生氧化反应
C.伴随能量变化的不一定是化学变化 D.电解池的阳极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
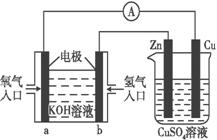
已知外电路中,电子由铜流向a极。有关如上图所示的
装置分析合理的一项是
A.该装置中Cu极为正极 B. 一段时间后锌片质量减少
C.b极的电极反应式:H2-2e- 2H+
2H+
D. 当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
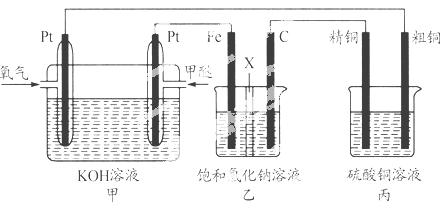
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式_______________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为______ ___ __,反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的标况下的体积为____ ____;丙装置中阴极析出铜的质量为____ ___ _。

查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ:元素X、Y、Z、E、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4,M元素与 Y元素能形成化合物MY2和化合物MY3,化合物MY2中两种元素质量分数相同;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,E、Z、N的最高价氧化物的水化物两两能反应,回答下列问题:
(1)写出Z最高价氧化物的水化物的电子式 ____________________。
(2)两个体积相等的恒容容器,甲容器通入1 mol MY2和1 mol Y2单质,乙容器通入1 mol MY3和0.5 mol Y2单质,发生反应:2 MY2 (g) + Y2(g)  2 MY3(g) △H<0,甲、乙起始反应温度相同,两容器均和外界无热量交换,平衡时,甲中MY2的转化率为a,乙中MY3的分解率为b,则
2 MY3(g) △H<0,甲、乙起始反应温度相同,两容器均和外界无热量交换,平衡时,甲中MY2的转化率为a,乙中MY3的分解率为b,则
①a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
②该条件下容器甲反应达平衡状态的依据是(填序号) 。
A.v正(Y2)=2v逆(MY3) B.混合气体的密度不变
C.c(MY2)=c(MY3) D.混合气体的总物质的量不变
E、容器内温度不变 F、MY2和Y2的质量比不变
(3)2.7克单质E与100ml 2mol/L Z的最高价氧化物的水化物充分反应,向反应后的溶液中滴入2 mol/L XN的溶液V ml,当溶液中产生3.9克沉淀时,求此时V的值 (写出计算过程)
Ⅱ:(4)已知在常温常压下:
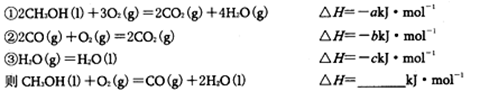
(5)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为_ ___
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
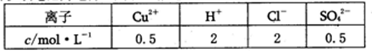
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上发生的电极反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其解释不正确的是( )
A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
质量相同的两种气体A、B,在同温、同压下,A的密度小于B。下列说法错误的是
A.A占的体积比B大 B. A的摩尔质量比B大
C.A的分子数比B多 D. A的物质的量比B大
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )
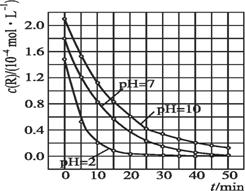
A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间,pH=10时R的平均降解速率为 0.04 mol·(L·min)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com