
��Ԫ��X��Y��Z��E��M��N��Ϊ����������Ԫ�أ���ԭ����������������֪YԪ��ԭ������������������������֮��Ϊ3��4��MԪ���� YԪ�����γɻ�����MY2�ͻ�����MY3��������MY2������Ԫ������������ͬ��N����Z����X���İ뾶��С��������XN�ڳ�����Ϊ���壬E��Z��N������������ˮ���������ܷ�Ӧ���ش��������⣺
��1��д��Z����������ˮ����ĵ���ʽ ____________________��
��2�����������ȵĺ���������������ͨ��1 mol MY2��1 mol Y2���ʣ�������ͨ��1 mol MY3��0.5 mol Y2���ʣ�������Ӧ��2 MY2 (g) + Y2(g)  2 MY3(g) ��H��0���ס�����ʼ��Ӧ�¶���ͬ���������������������������ƽ��ʱ������MY2��ת����Ϊa������MY3�ķֽ���Ϊb����
2 MY3(g) ��H��0���ס�����ʼ��Ӧ�¶���ͬ���������������������������ƽ��ʱ������MY2��ת����Ϊa������MY3�ķֽ���Ϊb����
��a��b�Ĺ�ϵΪa+b 1�������������������) ��
�ڸ�������������Ӧ��ƽ��״̬�������ǣ�����ţ� ��
A��v��(Y2)��2v��(MY3) B�����������ܶȲ���
C��c(MY2)��c(MY3) D���������������ʵ�������
E���������¶Ȳ��� F��MY2��Y2�������Ȳ���
��3��2.7�˵���E��100ml 2mol/L Z������������ˮ�����ַ�Ӧ,��Ӧ�����Һ�е���2 mol/L XN����ҺV ml������Һ�в���3.9�˳���ʱ�����ʱV��ֵ ��д��������̣�
��4����֪�ڳ��³�ѹ�£�
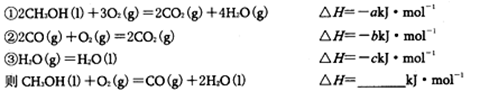
��5���ɼ״���������NaOH��Һ���ɵ������ֻ���أ���ʹ�ֻ�����ʹ��һ���²ų�һ�ε硣
�ٸõ�ظ����ĵ缫��ӦʽΪ_ ___
�����Ըõ��Ϊ��Դ����ʯī���缫���200mL�����������ӵ���Һ��
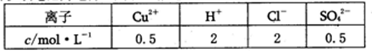
���һ��ʱ��������ռ�����ͬ�������ͬ������������ʱ��������Һ����ı仯���缫������ܴ��ڵ��ܽ����������Ϸ����ĵ缫��Ӧ ��
��֪ʶ�㡿Ԫ�����ڱ�����ѧƽ�⡢�Ȼ�ѧ����ʽ���绯ѧԭ��
���𰸽�������1��  ��2���� �� �� DEF
��2���� �� �� DEF
��3�� 75mL ����175mL ��д��������̣������ԣ�4�� 0.5��b-a-4c�� ��5����CH3OH��6e��+ 8 OH�� = CO32��+ 6 H2O �� 4OH�D�D4e�� = O2 ��+ 2H2O
������Ԫ��X��Y��Z��E��M��N��Ϊ����������Ԫ�أ���ԭ����������������֪YԪ��ԭ������������������������֮��Ϊ3��4���ƶ�Y����Ԫ�أ�MԪ���� YԪ�����γɻ�����MY2�ͻ�����MY3��������MY2������Ԫ������������ͬ����M����Ԫ�أ�N����Z����X���İ뾶��С��������XN�ڳ�����Ϊ���壬��X����Ԫ�أ�Z����Ԫ�أ�������Ԫ�أ�E��Z��N������������ˮ���������ܷ�Ӧ���������Ԫ�ء�
��1��Z����������ˮ������NaOH�������ʽΪ��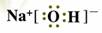 ��
��
��2����2 SO2 (g) + O2(g)  2 SO3(g)������ͨ��1 mol SO2��1 mol O2���ʣ�������ͨ��1 mol SO3��0.5 mol O2���ʣ�����������Ľ��������ǵ�Ч�ģ�����û���Ƚ������������¶�����SO2 (g)��ת���ʽ��ͣ��������¶Ƚ���SO3(g)�ķֽ��ʽ��ͣ����ԣ�a+b��< 1
2 SO3(g)������ͨ��1 mol SO2��1 mol O2���ʣ�������ͨ��1 mol SO3��0.5 mol O2���ʣ�����������Ľ��������ǵ�Ч�ģ�����û���Ƚ������������¶�����SO2 (g)��ת���ʽ��ͣ��������¶Ƚ���SO3(g)�ķֽ��ʽ��ͣ����ԣ�a+b��< 1
��A��2v��(Y2)��v��(MY3) ʱ�������ж�ƽ�⣬��A����B����Ϊ�Ǻ����ܱ������������غ㣬�ʻ��������ܶȲ��䲻����Ϊ�оݣ���B����C��c(MY2)��c(MY3) ������Ϊƽ������ݣ���C���� D���ǵ��巴Ӧ���������������ʵ�������˵����ƽ�⣬��D��ȷ��E���������¶Ȳ���ʱ��ƽ�� F��MY2��Y2�������Ȳ���ʱ��ƽ�⡣��ѡDEF��
��3��2.7�˵���Al�����ʵ�����0.1mol����100ml 2mol/LNaOH����0.2mol����ַ�Ӧ2Al+2OH- +2H2O=2AlO2- +3H2��,��Ӧ�����Һ������������ʣ��0.1 mol������2 mol/L HCl����ҺV ml������Һ�в���3.9�ˣ�0.05mol������ʱ��HCl�Ⱥ�NaOH��Ӧ����Ӧ��NaAlO2+HCl+H2O=Al(OH)3�� +NaCl�������μ�������Al(OH)3�ܽ�Al(OH)3+3HCl=AlCl3+3H2O���������Ĺ�ϵ����Ҫ���������Ϊ75mL ����175mL��
��4�����ø�˹���ɣ�1/2����-1/2����+2���۵�Ŀ�귽��ʽ�����ԣ���H=0.5��b-a-4c��
��5���״���������NaOH��Һ���ɵ�أ��״����������缫��Ӧʽ��CH3OH��6e��+ 8 OH�� = CO32��+ 6 H2O �������Ըõ��Ϊ��Դ����ʯī���缫���200mL��֪��Һʱ�����ݷŵ�˳����������������������ͬ�����������ɵ��������ʵ���Ϊx��������ҲӦ�����������ʵ���x
�����缫��ӦΪ��2Cl--2e-=Cl2���� 4OH--4e-=2H2O+O2����
0.4mol 0.4mol 0.2mol 4x 4x x
�����缫��ӦΪ��Cu2+ + 2e- = Cu�� 2H+ + 2e- = H2����
0.1mol 0.2mol 0.1mol 0.4mol 0.4mol 0.2mol
2H+ + 2e- = H2����
2x 2x x
���ݵ����غ�0.4+4x=0.2+0.4+2x
x=0.1mol
���Դ�ʱ���������ĵ缫��Ӧʽ��4OH�D�D4e�� = O2 ��+ 2H2O
��˼·�㲦�����⿼��ṹ����λ�ù�ϵ���ۺ�Ӧ�ã����ƶ�Ԫ���ǽ���ؼ���ע��������ʵ����ʣ���������ȷ��ȡ��Ϣ��������֪ʶ�������ϣ����÷������ۺϵķ��������ѧ���⡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1����1�֣�ʵ�����о���ѧ�Ļ��������й���ʵ���������������ȷ���ǣ�������
A����ʢ�з�ˮ���ձ��еμ�FeCl3��Һ����ʱ����У��Ʊ�Fe��OH��3����
B��ij��Һ�������ữ�����������ٵμ��Ȼ�����Һ�а�ɫ�������ɣ�˵����Һ����SO42��
C���Ʊ�����ʢ��ú�͵�ϸ���Լ�ƿ��
D������0.1mol/L��H2SO4��Һʱ������ȡ��Ũ���ᵹ������ƿ�м�ˮϡ�����̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ũ�Ȼ����Һ����������̨Ļ�������Ż���ԭ����
��Ļ�����Ż�����ߡ���Ļ�����������ӡ����Ȼ�立ֽ������������������¶ȡ����Ȼ�立ֽ��������������˿���
A���٢ڡ������� B���ۢ� C���٢� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ԫ�ص��⻯����������ڹ�ҵ�������������ж��й㷺Ӧ�ã��ش��������⣺
(1)��Ԫ����Ԫ�����ڱ��е�λ��Ϊ ��
(2)NH3��NaClO��Ӧ�ɵõ���(N2H4)���÷�Ӧ�Ļ�ѧ����ʽΪ ��
(3)�¿���Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪����N2(g)+2O2(g)= N2O4 (1) ��H1= -19.5kJ��mol-1
��N2H4 (1) + O2(g)= N2(g) + 2 H2O��g�� ��H2= -534.2kJ��mol-1
д���º�N2O4 ��Ӧ���Ȼ�ѧ����ʽ ��
(4)��һ����ȼ�ϵ����һ�ּ��Ե�أ��õ�طŵ�ʱ�������ķ�ӦʽΪ
(5)��ͼ��һ���绯ѧ����ʾ��ͼ��

��д����Ƭ�Ϸ����ĵ缫��Ӧʽ____ ____��
�ڼ���ʹ���£�����ȼ�ϵ����Ϊ�������еĵ�Դ��ͭƬ�������仯128 g�����£�����ȼ�ϵ�����������ı�״���µĿ���_____ ___L(��������������������Ϊ20%)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӻ�������д���������������ӦҪ�����
A��K+��AlO2����Cl����MnO4�� Ҫ����ɫ������Һ
B��Fe3+��NO3����I����HCO3�� Ҫ����εμ�����������������
C��Na+��K+��Ag+��NO3�� Ҫ����εμӰ�ˮ���г����������������ʧ
D��NH4+��Al3����SO42����CH3COOH Ҫ�μ�NaOHŨ��Һ���̲�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и����������Ͻ��з�Ӧ���������������������г������ɵ���(����)
�ٽ�����Ͷ��FeCl2��Һ�С��ڹ�����NaOH��Һ��������Һ��Ӧ��������CaOͶ�뵽������NaHCO3��Һ�С���Na2O2Ͷ�뵽CuSO4��Һ��
A���٢� B���ۢ�
C���ڢ� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ�鷽���У����ܲⶨNa2CO3��NaHCO3�������Na2CO3������������(����)
A��ȡa�˻�����ּ��ȣ�����b��
B��ȡa�˻����������ϡ�����ַ�Ӧ�����ȡ����ɡ����գ���b�˹���
C��ȡa�˻����������ϡ�����ַ�Ӧ���ݳ������ü�ʯ�����գ�����b��
D��ȡa�˻����������Ba(OH)2��Һ��ַ�Ӧ�����ˡ�ϴ�ӡ���ɣ���b�˹���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ��������240 mL 0.1 mol��L��1������ͭ��Һ����ѡȡ250 mL����ƿ�������ƣ����²��������Ƴɹ����ǣ� ��
A����ȡ3.84 g CuSO4��ĩ������250 mLˮ
B����ȡ6.25 g CuSO4��5H2O���壬��ˮ���250 mL��Һ
C����ȡ4.0 g CuSO4��ĩ������250 mLˮ
D����ȡ4.0 g CuSO4��5H2O���壬��ˮ���250 mL��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)һ�������µ��ܱ�������,��Ӧ3H2(g)+3CO(g) CH3OCH3(������)(g)+CO2(g)����H<0�ﵽƽ��,Ҫ���CO��ת����,���Բ�ȡ�Ĵ�ʩ�ǡ�������(����ĸ����)�� [
CH3OCH3(������)(g)+CO2(g)����H<0�ﵽƽ��,Ҫ���CO��ת����,���Բ�ȡ�Ĵ�ʩ�ǡ�������(����ĸ����)�� [
a.�����¶� b.������� c.��СCO2��Ũ��
d.����CO��Ũ�� e.�����������
(2)��֪��Ӧ��2CH3OH(g) CH3OCH3(g)+H2O(g)��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶���,���ܱ������м���CH3OH,��Ӧ��ijʱ�̲�ø���ֵ�Ũ������:
CH3OCH3(g)+H2O(g)��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶���,���ܱ������м���CH3OH,��Ӧ��ijʱ�̲�ø���ֵ�Ũ������:
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/(mol��L-1) | 0.44 | 0.6 | 0.6 |
�ٱȽϴ�ʱ�����淴Ӧ���ʵĴ�С:v(��)��������v(��)(�>����<����=��)��
��������CH3OH��,��10 min��Ӧ�ﵽƽ��,��ʱc(CH3OH)=��������;��ʱ���ڷ�Ӧ����v(CH3OH)=����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com