
下列各组物质相互混合进行反应,既有气体生成最终又有沉淀生成的是( )
①金属钠投入FeCl2溶液中 ②过量的NaOH溶液和明矾溶液反应 ③少量CaO投入到过量的NaHCO3溶液中 ④Na2O2投入到CuSO4溶液中
A.①③ B.③④
C.②③ D.①④
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
下列有关金属元素特征的叙述正确的是( )
|
| A. | 金属元素的原子只有还原性,其阳离子只有氧化性 |
|
| B. | 在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,所以铝的还原性比钠强 |
|
| C. | 钠元素在自然界中以化合态存在 |
|
| D. | 金属元素的单质在常温下都为固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2CO(g)+O2(g)=2CO2 (g) △H= -566 kJ.mol-1
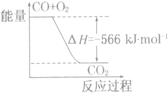 Na2O2(s)+CO2(g)=Na2CO3 (s)+ 1/2O2 (g) △H= -226 kJ.mol-1
Na2O2(s)+CO2(g)=Na2CO3 (s)+ 1/2O2 (g) △H= -226 kJ.mol-1
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H= - 452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2x6.02×l023
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C8H10O的芳香族化合物,遇三氯化铁溶液不显色,能与金属钠反应放出氢气,
满足条件的同分异构体有
A.4种 B.5种 C.10种 D.大于10种
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ:元素X、Y、Z、E、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4,M元素与 Y元素能形成化合物MY2和化合物MY3,化合物MY2中两种元素质量分数相同;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,E、Z、N的最高价氧化物的水化物两两能反应,回答下列问题:
(1)写出Z最高价氧化物的水化物的电子式 ____________________。
(2)两个体积相等的恒容容器,甲容器通入1 mol MY2和1 mol Y2单质,乙容器通入1 mol MY3和0.5 mol Y2单质,发生反应:2 MY2 (g) + Y2(g)  2 MY3(g) △H<0,甲、乙起始反应温度相同,两容器均和外界无热量交换,平衡时,甲中MY2的转化率为a,乙中MY3的分解率为b,则
2 MY3(g) △H<0,甲、乙起始反应温度相同,两容器均和外界无热量交换,平衡时,甲中MY2的转化率为a,乙中MY3的分解率为b,则
①a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
②该条件下容器甲反应达平衡状态的依据是(填序号) 。
A.v正(Y2)=2v逆(MY3) B.混合气体的密度不变
C.c(MY2)=c(MY3) D.混合气体的总物质的量不变
E、容器内温度不变 F、MY2和Y2的质量比不变
(3)2.7克单质E与100ml 2mol/L Z的最高价氧化物的水化物充分反应,向反应后的溶液中滴入2 mol/L XN的溶液V ml,当溶液中产生3.9克沉淀时,求此时V的值 (写出计算过程)
Ⅱ:(4)已知在常温常压下:
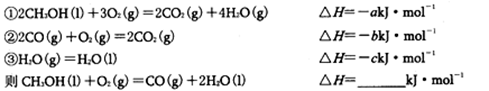
(5)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为_ ___
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
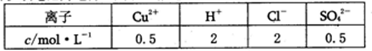
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上发生的电极反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于钠及其化合物的叙述正确的是( )
A.将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色
B.用钠与空气反应制纯净的Na2O2,空气必须经过碱石灰处理后,才能与钠反应
C.钠与钠离子都具有强还原性
D.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如图所示。请回答下列问题:
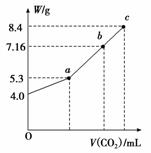
(1)b点时M的组成成分为____________________。
(2)若要使b点生成的盐的质量变为8.4 g,则应继续向溶液中通入二氧化碳________L(标准状况下)。
(3)若向生成的7.16 g盐的溶液中加入一定量的某物质,充分反应后,减压低温蒸发得到纯净的碳酸钠固体(无结晶水)8.4 g。
①若只加入0.03 mol某物质,则加入的物质可以是________或________。
②若只加入0.06 mol某物质,则加入的物质可以是________、________或________。
(4)常温下,同浓度的碳酸钠溶液和碳酸氢钠溶液的pH都大于7,二者中________的pH更大,理由是__________
________________________________________________________________________;
0.1 mol·L-1碳酸钠溶液中离子浓度的大小关系是
________________________________________________________________________;
向碳酸氢钠溶液中逐滴滴入氢氧化钡溶液,发生反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将15%的NaOH溶液蒸发掉100 g水后得到125 ml质量分数为30%的NaOH溶液,则此时溶液的物质的量浓度为( )
A.6 mol·L-1 B.6.25 mol·L-1 C.6.75 mol·L-1 D.7 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
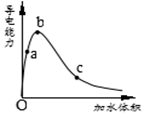
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com