
向100 mL NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入二氧化碳的体积V(标准状况下)与M的质量W的关系如图所示。请回答下列问题:
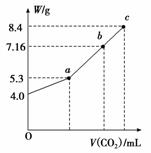
(1)b点时M的组成成分为____________________。
(2)若要使b点生成的盐的质量变为8.4 g,则应继续向溶液中通入二氧化碳________L(标准状况下)。
(3)若向生成的7.16 g盐的溶液中加入一定量的某物质,充分反应后,减压低温蒸发得到纯净的碳酸钠固体(无结晶水)8.4 g。
①若只加入0.03 mol某物质,则加入的物质可以是________或________。
②若只加入0.06 mol某物质,则加入的物质可以是________、________或________。
(4)常温下,同浓度的碳酸钠溶液和碳酸氢钠溶液的pH都大于7,二者中________的pH更大,理由是__________
________________________________________________________________________;
0.1 mol·L-1碳酸钠溶液中离子浓度的大小关系是
________________________________________________________________________;
向碳酸氢钠溶液中逐滴滴入氢氧化钡溶液,发生反应的离子方程式为________________________________________________________________________。
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
下列有关氧化还原反应的叙述正确的是( )
|
| A. | 有单质参加或有单质生成的反应一定是氧化还原反应 |
|
| B. | 在CaH2+2H2O═Ca(OH)2+2H2↑中,1 mol水得到1mol电子 |
|
| C. | 氧化还原反应的特征是电子的转移 |
|
| D. | 得电子的反应物在反应中作氧化剂,反应中被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素在元素周期表中的位置为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为
(5)下图是一个电化学过程示意图。

①写出铂片上发生的电极反应式____ ____。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128 g,则肼-空气燃料电池理论上消耗标准状况下的空气_____ ___L(假设空气中氧气体积含量为20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合进行反应,既有气体生成最终又有沉淀生成的是( )
①金属钠投入FeCl2溶液中 ②过量的NaOH溶液和明矾溶液反应 ③少量CaO投入到过量的NaHCO3溶液中 ④Na2O2投入到CuSO4溶液中
A.①③ B.③④
C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是
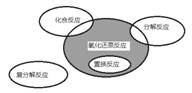 A.Cl2+2KBr===Br2+2KCl
A.Cl2+2KBr===Br2+2KCl
B.2NaHCO3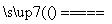 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.2Na2O2+2CO2===2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需用240 mL 0.1 mol·L-1的硫酸铜溶液,现选取250 mL容量瓶进行配制,以下操作能配制成功的是( )
A.称取3.84 g CuSO4粉末,加入250 mL水
B.称取6.25 g CuSO4·5H2O晶体,加水配成250 mL溶液
C.称取4.0 g CuSO4粉末,加入250 mL水
D.称取4.0 g CuSO4·5H2O晶体,加水配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要11.2L(标准状况)二氧化碳,现用含碳酸钙90.0﹪的石灰石与足量的稀盐酸反应(该石灰石中的杂质不与稀盐酸反应),问:
(1)至少需要含碳酸钙90.0﹪的石灰石多少克?
(2)生成的氯化钙的物质的量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温、恒压下,在一个容积可变的容器中发生如下反应:
N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
(1)若开始时放入1mol N2和3 molH2,达到平衡后,生成a mol NH3,这时N2的物质的量为 mol;
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为 mol和 mol;
(3)若开始时放入x mol N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x= ,y= ,平衡时H2的物质的量_____(选填一个编号)。
A.大于6 mol B.等于6 mol C.小于6 mol D.可能大于、小于或等于6 mol
作出判断的理由是 ;
(4)若在(3)的平衡混合物中,再加入6 molNH3,再次达到平衡后,NH3的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com