
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )
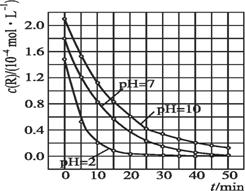
A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间,pH=10时R的平均降解速率为 0.04 mol·(L·min)-1
科目:高中化学 来源: 题型:
下列离子或分子组中大量共存且满足相应要求的是
A.K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液
B.Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体
C.Na+、K+、Ag+,NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失
D.NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学配制一定物质的量浓度的硫酸溶液,下列情况会造成所配溶液浓度偏低的是( )
A.定容时时俯视刻度线 B.量筒量取5ml浓硫酸时俯视读数
C.容量瓶中有蒸馏水 D.溶解后未经冷却就转移到容量瓶进行定容
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应3A(g)+B(s)  2C(g)+2D(g) ΔH >0达到平衡后,改变以下条件,下列说法正确的是( )
2C(g)+2D(g) ΔH >0达到平衡后,改变以下条件,下列说法正确的是( )
A.增大压强,正、逆反应速率同等程度增大,平衡不移动
B.升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动
C.增加A的浓度,平衡向正方向移动,平衡常数增大
D.增加B的用量,正、逆反应速率不变,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
B.NH4HCO3(s) NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。 [
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。 [
a.升高温度 b.加入催化剂 c.减小CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:A2(?)+B2(?)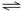 2AB(?);ΔH=-Q kJ/mol,当温度和压强改变时n(AB)的变化如图,下列叙述正确的是
2AB(?);ΔH=-Q kJ/mol,当温度和压强改变时n(AB)的变化如图,下列叙述正确的是
A. A2、B2及AB均为气体,Q>0
B.AB为气体,A2、B2至少有一种为非气体,Q>0
C.AB为气体,A2、B2有一种为非气体,Q<0
D.AB为固体,A2、B2有一种为非气体,Q>0

查看答案和解析>>
科目:高中化学 来源: 题型:
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1 mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是( )
(提示:KspAgCl>KspAgI)
A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B.图中x点的坐标为(10,6 )
C.图中x点表示溶液中Ag+ 与Cl— 浓度相同
D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在
终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,某化合物X受热分解:2X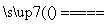 A↑+2B↑+4C↑测得反应后生成的混合气体对H2的相对密度为11.43,相同条件下,X的相对分子质量是 ( )
A↑+2B↑+4C↑测得反应后生成的混合气体对H2的相对密度为11.43,相同条件下,X的相对分子质量是 ( )
A.11.43 B.22.85 C.80.01 D.160.02
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com