
某温度下,体积一定的密闭容器中进行如下可逆反应( )
X(g)+Y(g)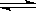 Z(g)+W(s);ΔH>0下列叙述正确的是
Z(g)+W(s);ΔH>0下列叙述正确的是
A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的ΔH增大
D.平衡后加入X,上述反应的ΔH增大
科目:高中化学 来源: 题型:
下列物质分类正确的是
①混合物:铝热剂、福尔马林、水玻璃、漂白粉 ②化合物:氯化钙、烧碱、冰水混合物、胆矾 ③电解质:明矾、二氧化碳、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 ⑤同素异形体:C60、C70、金刚石、石墨
A、①②④ B、②③④ C、①②⑤ D、②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
选用正确的试剂和分离方法,除去下列物质中所含少量杂质(括号内为杂质):
例: 乙醇(水)生石灰,蒸馏
(1)苯(苯酚) ;(2)甲烷(乙烯) ;(3)乙酸乙酯(乙酸) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
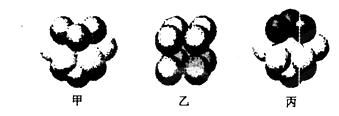
查看答案和解析>>
科目:高中化学 来源: 题型:
反应 2A(g) + B(g)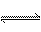 2C(g);△H > 0 。下列反应有利于生成C的是( )
2C(g);△H > 0 。下列反应有利于生成C的是( )
A. 低温、低压 B. 低温、高压 C. 高温、高压 D. 高温、低压
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下在密闭容器中发生如下反应3 M(g)+ N(g) 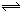 2G(g)
2G(g)
若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入3 molM和1molN的混合气体,达平衡时M的转化率为 ( )
A.20% B.40% C.60% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。(写出计算过程)
N2O4(g)的平衡常数K。(写出计算过程)
(2)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到上述平衡时的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的钠、镁、铝分别与足量稀盐酸反应,在同温同压下放出H2的体积比为( )
|
| A. | 1:2:3 | B. | 1:1:1 | C. | 3:2:1 | D. | 2:3:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com