
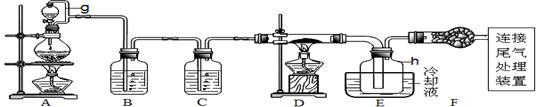
 Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分) Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;

 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源:不详 题型:单选题
| A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 |
| B.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性 |
| C.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+ |
| D.锌与稀硝酸反应得不到氢气,说明稀硝酸能使锌钝化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
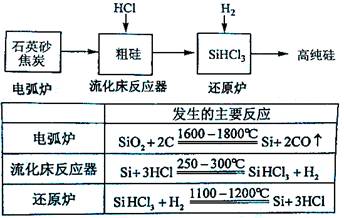
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
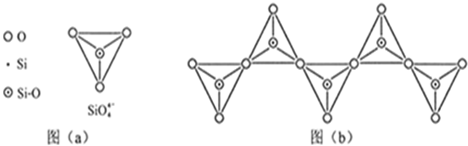
科目:高中化学 来源:不详 题型:填空题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.青石棉是一种易燃品,且易溶于水 |
| B.青石棉的化学组成用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O |
| C.1 mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗8.5 L 2 mol·L-1 HNO3溶液 |
| D.1 mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗7 L 2 mol·L-1 HF溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.它耐高温抗氧化 |
| B.它比钢铁轻、硬,但质地较脆 |
| C.它没有固定熔点 |
| D.它是一种新型无机非金属材料 |
查看答案和解析>>
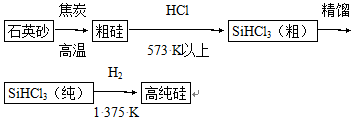
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2、CH4、N2等均是造成温室效应的气体 |
| B. 14C可用于文物鉴定,14C与12C互为同素异形体 |
| C.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
D.精炼粗铝时要清除坩埚表面的石英砂,铝与石英砂反应的方程式为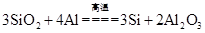 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com