
【题目】用如图所示装置进行实验(a、b电极均为Ag单质),观察到了灵敏电流计指针发生偏转。下列说法正确的是
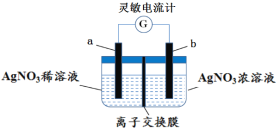
A.b极电极反应式为Ag–e–= Ag+
B.离子交换膜为阴离子交换膜
C.去掉离子交换膜,电流表仍然有电流通过
D.电流计指针不再偏转时,右边硝酸银溶液的物质的量浓度依然大于左边
【答案】B
【解析】
由于AgNO3溶液浓度不同形成浓差电池,左池为稀的AgNO3溶液,右池为浓的AgNO3溶液,Ag+浓度越大氧化性越强,所以b为正极,发生还原反应,电极反应式为Ag++e-=Ag;a为负极,发生氧化反应,电极反应式为Ag-e-=Ag+,因正极与负极消耗或生成的Ag+相等,但负极Ag减少、正极Ag增加,溶液中迁移的离子不可能是Ag+,只能是NO3-穿过交换膜向负极移动,据此解答。据此解答。
A.浓差电池中,右池AgNO3溶液浓度高,Ag+浓度越大氧化性越强,所以b为正极,电极反应式为Ag++e-=Ag,A错误;
B.负极Ag减少、正极Ag增加,左侧溶液中Ag+增大,右侧溶液中由于Ag+放电而导致附近溶液中NO3-增大,为了维持电荷平衡,溶液中NO3-穿过交换膜由右侧向左侧的负极a区移动,因此离子交换膜为阴离子交换膜,B正确;
C.若去掉离子交换膜,溶液中离子扩散,最终形成均一浓度的溶液,没有浓度差,且两个电极材料相同,不能构成原电池,故电流表不会有电流通过,C错误;
D.随着反应进行,左右两池浓度的差值逐渐减小,NO3-穿过交换膜向负极移动的速率将减小,外电路中电流将减小,电流计指针偏转幅度逐步变小,当左右两侧离子浓度相等时,电池将停止工作、不再有电流产生,此时溶液中左、右边硝酸银溶液的物质的量浓度相等,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。

(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土铈(Ce)元素主要存在于独居石中,金属铈化学性质十分活泼。近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<![]() <2,下列说法不正确的是
<2,下列说法不正确的是

A.CeO2是水分解的催化剂
B.T<1050℃时,CeO2比CeO2—δ稳定
C.工业上可用电解CeCl4溶液制备Ce
D.过程②的方程式为CeO 2—δ+δH2O![]() CeO2+δH2
CeO2+δH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是 ( )。
A. 原子半径X>Y B. 氢化物稳定性H2X>HY
C. 原子核内质子数R<M D. 溶液碱性R(OH)2<M(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在无氧条件下,葡萄糖发生反应C6H12O6![]() 2CH3CH2OH + 2CO2↑。设NA是阿伏伽德罗常数的值。下列说法正确的是
2CH3CH2OH + 2CO2↑。设NA是阿伏伽德罗常数的值。下列说法正确的是
A.0.1 mol葡萄糖(C6H12O6)含羟基(-OH)数目为0.6NA
B.常温常压下,46 g CH3CH2OH与足量的钠反应产生氢分子数为0.5NA
C.4.48 L CO2和CO的混合气体所含碳原子总数为0.2NA
D.2.4 g Mg在足量的CO2中完全燃烧,转移电子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展新能源、改善空气质量等一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有__________;由于该反应速率较慢,需要加入催化剂使反应速率加快,主要降低下列变化中________(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。

①反应(I)的△H______0(填“>”、“=”或“<”);
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率________;此时CO的转化率为________;已知:反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算e处的![]() =______;
=______;
③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为________(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
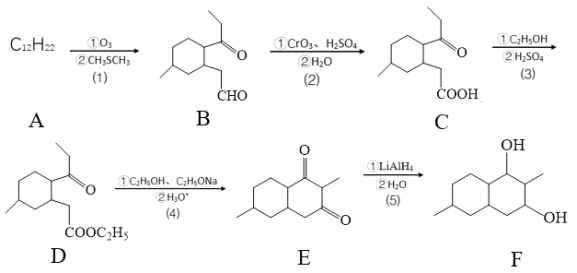
【题目】下列有关化学合物(F)的合成路线如下:
已知: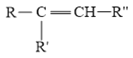
![]()
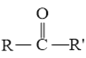 +R″-CHO
+R″-CHO
回答下列问题:
(1)化合物D官能团的名称是_________________。
(2)反应⑸的反应类型是____________。
(3)化合物A的键线式是____________。
(4)化合物B与新制的Cu(OH)2悬浊液反应的化学方程:____________。
(5)碳原子上连有4个不同的原子或原子团,该碳称为手性碳,则化合物C的手性碳原子数有____个。
(6)芳香化合物G是化合物E的同分异构体,且G满足以下两个条件:
①1molG与足量金属钾反应,在标准状况下放出22.4LH2;
②有三种不同化学环境的氢原子且它们的原子个数比为6:2:1。
则G可能的结构简式____________。
⑺设计由![]() 制备
制备 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如图所示,符合如图所示的情况是( )
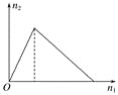
A.X为氢氧化钠,Y为氯化铝
B.X为氯化铝,Y为氢氧化钠
C.X为盐酸,Y为偏铝酸钠
D.X为偏铝酸钠,Y为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极极板,通过导线与直流电源相连。下列说法不正确的是 ( )
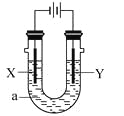
A. 若电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液
B. 若X为铁电极、Y为石墨电极,电解饱和氯化钠溶液一段时间,在两极分别滴加酚酞,X极变红色
C. 若用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氢氧化铜溶解,刚好恢复到通电前的浓度,则电解过程中转移的电子为0.2mol
D. 若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com