
【题目】发展新能源、改善空气质量等一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有__________;由于该反应速率较慢,需要加入催化剂使反应速率加快,主要降低下列变化中________(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。

①反应(I)的△H______0(填“>”、“=”或“<”);
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率________;此时CO的转化率为________;已知:反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算e处的![]() =______;
=______;
③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为________(填数值)。
【答案】CH2O A > 0.01 mol/(L·min) 50% 100 0.01 mol/L
【解析】
(1)由图可知,副产物有CO和CH2O,反应的能垒越低,反应越容易进行,副产物的量越多;反应的能垒越大,反应的反应速率越慢;
(2)①该反应正向是气体体积增大的反应,根据温度与化学平衡常数的对数关系分析温度与平衡移动的关系;
②根据图象确定Kp,利用物质加入量及转化量关系,确定平衡时各种物质的浓度,再根据化学反应速率和物质转化率的含义进行计算;根据e点lgKp计算CO转化率,得到各种气体的物质的量分数,结合该温度下的平衡常数,带入速率公式可得速率的比值;
③c点是两个反应的交点,二者的平衡常数相等,据此解答。
(1)由图可知生成副产物主要有CO和CH2O,其中的有机副产物是CH2O;由图可知生成甲醇的过程中,能垒最高(为1.64 eV)的变化为*CO+*OH→*CO+*H2O,该反应速率最慢,决定整个反应的快慢,所以要想提高整个反应速率,应该降低该反应的能垒,故合理选项是A;
(2)①根据图示可知:温度升高,lgKp增大,说明升高温度,平衡正向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,因此该反应的正反应为吸热反应,故△H>0;
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II) CO(g)+H2O(g)![]() CO2(g)+H2(g),反应5分钟到达图中d点,此时lgKp=0,则Kp=1,根据化学反应速率与物质反应关系,由于加入1 mol CO、1 mol H2O,反应是按1:1物质的量关系进行,剩余的CO、H2O也是1:1物质的量关系,反应产生的CO2与H2的物质的量相等,则每种气体的物质的量及浓度都相同,此时n(CO)=0.5 mol,c(CO)=c(H2O)=c(H2)=c(CO2)=
CO2(g)+H2(g),反应5分钟到达图中d点,此时lgKp=0,则Kp=1,根据化学反应速率与物质反应关系,由于加入1 mol CO、1 mol H2O,反应是按1:1物质的量关系进行,剩余的CO、H2O也是1:1物质的量关系,反应产生的CO2与H2的物质的量相等,则每种气体的物质的量及浓度都相同,此时n(CO)=0.5 mol,c(CO)=c(H2O)=c(H2)=c(CO2)= ![]() =0.05 mol/L,则0~5 min时,CO平均反应速率v(CO)=
=0.05 mol/L,则0~5 min时,CO平均反应速率v(CO)= ![]() =0.01mol/(L·min);此时CO的转化率为
=0.01mol/(L·min);此时CO的转化率为![]() ×100%=50%;由于反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),反应达到平衡时,v正=v逆,所以k正·x(CO)·x(H2O)=k逆·x(CO2)·x(H2),则
×100%=50%;由于反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),反应达到平衡时,v正=v逆,所以k正·x(CO)·x(H2O)=k逆·x(CO2)·x(H2),则![]() =K,e点时lgKp=-2,Kp=10-2,由于反应开始时c(CO)=c(H2O)=0.1 mol/L,c(H2)=c(CO2)=0,假设反应产生CO2、H2的物质的量浓度是a mol/L,则平衡时c(CO)=c(H2O)=(1-a)mol/L,c(H2)=c(CO2)=a mol/L,该反应是反应前后气体体积不变的反应,则Kp=
=K,e点时lgKp=-2,Kp=10-2,由于反应开始时c(CO)=c(H2O)=0.1 mol/L,c(H2)=c(CO2)=0,假设反应产生CO2、H2的物质的量浓度是a mol/L,则平衡时c(CO)=c(H2O)=(1-a)mol/L,c(H2)=c(CO2)=a mol/L,该反应是反应前后气体体积不变的反应,则Kp=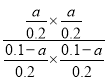 =10-2,解得a=0.1×
=10-2,解得a=0.1×![]() mol/L,c(CO)=c(H2O)=(1-a)mol/L=0.1×
mol/L,c(CO)=c(H2O)=(1-a)mol/L=0.1×![]() mol/L,所以x(CO)=x(H2O)=
mol/L,所以x(CO)=x(H2O)=![]() ,x(H2)=x(CO2)=
,x(H2)=x(CO2)=![]() ,根据图象可知,此温度下反应达到平衡时,Kp=1,所以e处的
,根据图象可知,此温度下反应达到平衡时,Kp=1,所以e处的![]() =Kp×
=Kp×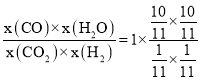 =100;
=100;
③对于反应(I)化学平衡常数K=![]() ;对于反应(II),化学平衡常数K=
;对于反应(II),化学平衡常数K=![]() ,由于c点是两个反应的交点,化学平衡常数相等,所以
,由于c点是两个反应的交点,化学平衡常数相等,所以![]() ,c(CO2)=c2(CO),由于此时反应容器中CO浓度为0.1 mol/L,所以c(CO2)=c2(CO)=(0.1)2 mol/L =0.01 mol/L。
,c(CO2)=c2(CO),由于此时反应容器中CO浓度为0.1 mol/L,所以c(CO2)=c2(CO)=(0.1)2 mol/L =0.01 mol/L。


科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm100nm之间
B.用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D.树林中的晨曦,该现象与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、F、Cu及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关问题:
(1)N原子中最高能级的电子的电子云轮廓图为___________;基态Cu+的核外电子排布式为____________。
(2)化合物(CH3)3N可用于制备医药、农药。分子中N原子杂化方式为________,该物质能溶于水的原因是_____________________。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,其阳离子的空间构型为_____________,写出一种与[H2F]+互为等电子体的分子______________(写化学式)。
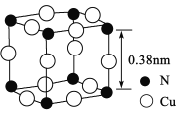
(4)氮、铜形成的一种化合物的晶胞结构如图所示。与每个Cu原子紧邻的Cu原子有____个,令阿伏加德罗常数的值为NA,该晶体的密度为______g/cm3。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3 mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应初始时观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。
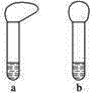
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如上图所示,则试管b中反应的离子方程式为___________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验(a、b电极均为Ag单质),观察到了灵敏电流计指针发生偏转。下列说法正确的是
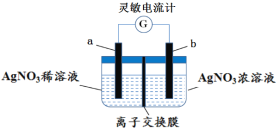
A.b极电极反应式为Ag–e–= Ag+
B.离子交换膜为阴离子交换膜
C.去掉离子交换膜,电流表仍然有电流通过
D.电流计指针不再偏转时,右边硝酸银溶液的物质的量浓度依然大于左边
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),以下化学反应速率的表示中,所表示反应速率最快的是
N2(g)+4CO2(g),以下化学反应速率的表示中,所表示反应速率最快的是
A. v(CO)=1.6 mol·(L·min) -1B. v(NO2)=0.9 mol·(L·min) -1
C. v(N2)=0.25mol·(L·min) -1D. v(CO2)=1.2 mol·(L·min) -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液。
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):________。

Ⅱ.测定稀硫酸和稀NaOH中和热的实验装置如下图所示。

(1)写出该反应的热化学方程式(中和热ΔH=-57.3 kJ·mol-1): _______________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:

1_______________2___________________3_______________________4________________________5温度差平均值____
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是________(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,

下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C. 金刚石的稳定性强于石墨
D. 断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,可以达到实验目的的是
选项 | 实验操作与现象 | 目的或结论 |
A | 用pH试纸分别测定相同温度和相同浓度的CH3COONa溶液和NaClO溶液的pH | 验证酸性:CH3COOH>HClO |
B | 在一定条件下,向混有少量乙烯的乙烷中通入氢气 | 除去乙烷中的乙烯 |
C | 向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分振荡,白色固体溶解 |
|
D | 向NaI、NaCl混合稀溶液中滴加少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com