
【题目】下列关于胶体的叙述不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm100nm之间
B.用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D.树林中的晨曦,该现象与丁达尔效应有关
科目:高中化学 来源: 题型:
【题目】新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为Mg17Al12+17H2═17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气.下列说法正确的是
A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B. 合金在吸氢过程中被H2还原
C. 一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D. 等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)> V(合金)>V(铝)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
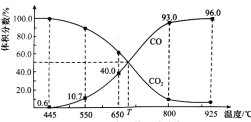
A. 550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡不移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。

(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上常用CO与H2合成甲醇,热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-574.4 kJ·mol-1。
CH3OH(g) ΔH=-574.4 kJ·mol-1。
(1)下图是表示一定温度下,在体积为2L的密闭容器中加入5mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。反应第10分钟达到平衡,从反应开始到平衡,用H2表示平均反应速率v(H2)=__mol/(L·min),且反应前后体系的压强之比为____。
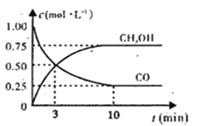
(2)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
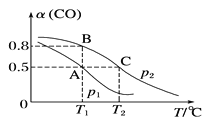
①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.由三种元素组成的化合物A,式量在200- -300之间。在一 定条件下A能发生如下图的转化,其中B的焰色反应为紫色(透过蓝色钴玻璃),C是不溶于酸的白色沉淀。

请回答∶
(1) C的化学式是______,组成A的三种元素是________。
(2) A加热分解的化学方程式是_____。
(3) E可以和SCl2反应生成一种常用于有机合成的物质SOCl2和另一种常见气体,反应的化学方程式是________。
II.实验室测定某铁铝合金中的铝含量,利用如图装置和试剂完成。

请回答∶
(1)下列有关该实验的说法中正确的是_______。
A.由于恒压分液漏斗的存在,该装置不能进行气密性检查
B.读数前需将量气管C上下移动使B、C中的液面相平
C.反应完成后生成的氢气都要转移至装置B中
D.需要控制NaOH的量以防止产生气体过多超过量气装置的量程
(2)若将恒压分液漏斗(A) 去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量______,(填“偏大”、“偏小”或“不变”),请说明理由_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3 mol O2加入V L的反应器中,在高温下放电,经t1 s 建立了平衡体系:3O2![]() 2O3,此时测知O2的转化率为30%,下列图像能正确表示气体的物质的量(n)跟时间(t)的关系的是
2O3,此时测知O2的转化率为30%,下列图像能正确表示气体的物质的量(n)跟时间(t)的关系的是
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展新能源、改善空气质量等一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有__________;由于该反应速率较慢,需要加入催化剂使反应速率加快,主要降低下列变化中________(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。

①反应(I)的△H______0(填“>”、“=”或“<”);
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率________;此时CO的转化率为________;已知:反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算e处的![]() =______;
=______;
③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为________(填数值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com