
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
【答案】A
【解析】
Mg与氧气反应生成MgO,与二氧化碳反应生成MgO与C,根据相同质量的Mg生成MgO和MgO及C固体的质量增重大小分析解答。
A. Mg与氧气反应生成MgO,与二氧化碳反应生成MgO与C,因此等质量的镁在二氧化碳中燃烧产生的固体质量大,A正确;
B.根据选项A分析可知等质量的镁在二氧化碳中燃烧产生的固体质量大,在氧气中产生的氧化镁质量小,B错误;
C.镁分别在足量的氧气、二氧化碳中燃烧方程式为:2Mg+O2![]() 2MgO,2Mg+CO2
2MgO,2Mg+CO2![]() 2MgO+C,在两个反应中,Mg作还原剂,O2、CO2作氧化剂,所以根据方程式可知两个反应中氧化剂与还原剂物质的量之比都是1∶2,C错误;
2MgO+C,在两个反应中,Mg作还原剂,O2、CO2作氧化剂,所以根据方程式可知两个反应中氧化剂与还原剂物质的量之比都是1∶2,C错误;
D.在Mg与CO2的反应中,被还原的元素是C元素,D错误;
故合理选项是A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有如下反应(未配平):BrF3+H2O→Br2+O2+HBrO3+HF,反应后测得生成Br2与O2各1 mol。下列判断错误的是
A.反应共转移6 mol电子
B.氧化剂为BrF3,还原产物为Br2
C.配平后H2O与HF的物质的量之比为5∶9
D.被水还原的BrF3与被自身还原的BrF3的物质的量之比是1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJmol-1
O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJmol-1
H2(g)+![]() O2(g)=H2O(1)△H2=-285.8kJmol-1
O2(g)=H2O(1)△H2=-285.8kJmol-1
H2O(g)=H2O(l) △H3=-44kJmol-1
则CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为__。
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
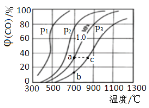
①压强p1__1.0MPa(填>、=或<)。
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为__,该反应的平衡常数Kp=__(保留小数点后一位数字)(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___(写一条即可)。
CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___(写一条即可)。
②在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。
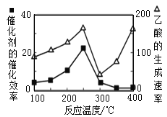
(4)将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为___mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、为测定金属钠样品(表面有 Na2O)中钠单质的质量分数,设计了如下实验(反应装置如图所示):
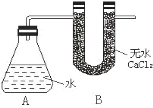
①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2 干燥 剂)的橡皮塞 。有关数据是:称取的金属钠样品质量为 a g,A、B反应前总质量为 m g,反应后 A、B 的总质量为 n g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠浮在水面,产生这一现象原因是:_____________
(2)用 a、m、n 表示的钠单质的质量分数为_______________
(3)如果没有 B 装置对实验结果有何影响___________。(填“偏大”或“偏小”“不影响”)
Ⅱ、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:
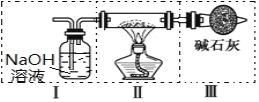
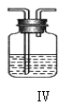
(4)上述装置Ⅳ中盛放的试剂是______,为完成实验应将装置Ⅳ接在_____(填写字母号)。
A.I 之前 B. II 和 III 之间 C.I 和 II 之间 D.III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为______________。
Ⅲ、现用制得纯度较高的 Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉_______(填“能”或“不能”)燃烧起来。
(7)盛有1.56 g Na2O2、3.36g NaHCO3的固体混合物放在密闭容器中加热,最后固体是___________(填化学式),质量为_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示:
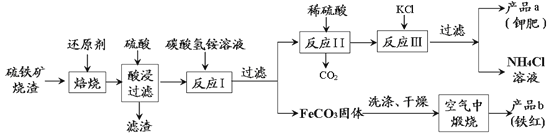
(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是______。
A.铝 B.锌 C.碳
(2)酸浸、过滤后滤液中的主要成分是________。滤渣是__________。
(3)反应Ⅰ的溶液为防止被氧化,需加___________,其离子方程式为__________________。
(4)反应Ⅰ的反应温度一般需控制在15℃以下,其目的是____________________。
(5)空气中煅烧FeCO3生成产品b的化学反应方程式为_____________________。
(6)检验产品a中是否含有氯化物杂质的实验操作是:取少量产品a于试管中配成溶液,___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废物利用有利于环境保护、资源节约,一种从废催化剂(含ZnO、CuO及少量石墨、Fe2O3及MnO2等)回收铜并制取活性氧化锌的工艺流程如图:
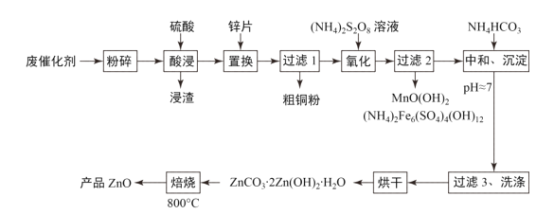
(1)为提高酸浸的速率,还可采取的措施为___。
(2)“氧化”时2molMn2+被氧化为MnO(OH)2,需要(NH4)2S2O8的物质的量为___。
(3)已知Zn(OH)2性质与Al(OH)3类似,在“中和、沉淀”时pH不能过大,请用文字结合离子方程式解释原因___。
(4)“过滤3、洗涤”时,对所得滤液蒸发浓缩、冷却结晶可得___(填主要物质的化学式)固体。
(5)“焙烧”过程中化学方程式为___。
(6)经测定,1kg废催化剂可得160g粗铜粉,又知粗铜粉中铜的质量分数为80%,则废催化剂中铜的质量分数为___%,若“酸浸”时硫酸浓度变小而又没有及时补充,则测定结果会比实际情况___(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
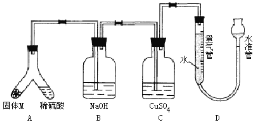
由上述实验事实可知:
(1)①固体M中一定有的物质是____________(填化学式) 理由是_________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________,B装置的作用_____________。
(3)C装置的作用是______,如果实验中没有B装置,则C装置中产生的现象是_______。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
A.M中有未反应的铁和硫 B.测定气体体积时水准管的水面高于量气管的水面
C.A中留有反应生成的气体 D.气体进入D装置前未用浓硫酸干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
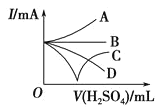
【题目】(1)现有下列物质:①K2SO4晶体;②液态SO3;③冰醋酸(即纯醋酸);④汞;⑤小苏打;⑥蔗糖;⑦乙醇;⑧熔融的氯化钠。其中:能导电的是______________(填序号,下同);属于非电解质的是_________属于强电解质的是_____________;弱电解质的电离方程式:_________
(2)已知0.1 mol/L的NaHSO4溶液中H+的浓度为0.1mol/L,若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1:1混合,离子方程式为________,此时溶液呈____性。
(3)若向Ba(OH)2溶液中缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的_________(填序号)曲线表示。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com