
【题目】(1)现有下列物质:①K2SO4晶体;②液态SO3;③冰醋酸(即纯醋酸);④汞;⑤小苏打;⑥蔗糖;⑦乙醇;⑧熔融的氯化钠。其中:能导电的是______________(填序号,下同);属于非电解质的是_________属于强电解质的是_____________;弱电解质的电离方程式:_________
(2)已知0.1 mol/L的NaHSO4溶液中H+的浓度为0.1mol/L,若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1:1混合,离子方程式为________,此时溶液呈____性。
(3)若向Ba(OH)2溶液中缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的_________(填序号)曲线表示。
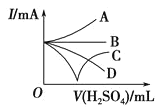
【答案】④⑧ ②⑥⑦ ①⑤⑧ CH3COOH![]() CH3COO-+H+ H++SO42-+OH-+Ba2+=BaSO4↓+H2O 碱 C
CH3COO-+H+ H++SO42-+OH-+Ba2+=BaSO4↓+H2O 碱 C
【解析】
(1)根据含有自由移动的带电微粒(如离子、电子)的物质能导电;电解质是在熔融态或在水溶液里能导电的化合物,非电解质是在水溶液里和熔融状态下都不能导电的化合物,强电解质是在水溶液中完全电离的电解质;弱电解质是在水溶液中只有部分电离产生自由移动的离子,存在电离平衡;
(2)根据二者反应的物质的量比关系,书写反应方程式和离子方程式,根据溶液中c(H+)、c(OH-)的相对大小,判断溶液的酸碱性;
(3)开始时溶液中含有大量的Ba2+、OH-,溶液导电能力很强,稀硫酸不断加入,直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强;
(1)④汞中含有自由移动的电子,能够导电;⑧熔融的氯化钠中含有自由移动的Na+、Cl-,能够导电,故能够导电的选项是④⑧;
②液态SO3;⑥蔗糖;⑦乙醇都是由分子构成的化合物,在水溶液或熔融状态,都不能因自身电离产生自由移动的微粒而导电,因此都是非电解质,故属于非电解质的选项是②⑥⑦;
①K2SO4晶体、⑤小苏打、⑧熔融的氯化钠都属于可溶性的盐,在水中能够完全电离,属于强电解质,故属于强电解质的选项是①⑤⑧;
③冰醋酸(即纯醋酸)由分子构成,溶于水后,在水分子作用下,能够部分电离,产生自由移动的CH3COO-、H+,存在电离平衡,属于弱电解质,电离方程式为:CH3COOH![]() CH3COO-+H+;
CH3COO-+H+;
(2)已知0.1 mol/L的NaHSO4溶液中H+的浓度为0.1mol/L,NaHSO4在水中电离方程式为:NaHSO4=Na++H++SO42-,若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1:1混合,发生反应:NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,离子方程式为H++SO42-+OH-+Ba2+=BaSO4↓+H2O,此时溶液中c(OH-)>c(H+),所以溶液呈碱性;
(3)向Ba(OH)2溶液中缓缓加入稀H2SO4直至过量,恰好反应时,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,反应开始时,溶液中含有Ba(OH)2电离产生的Ba2+、OH-,溶液导电能力很强,随着硫酸的加入,溶液中Ba2+、OH-浓度降低,溶液的导电性减弱,当二者恰好反应时,溶液中几乎无自由移动的离子,导电性为0,当硫酸过量时,溶液中又有硫酸电离产生的H+、SO42-,且硫酸越多,溶液中过量硫酸电离产生H+、SO42-离子浓度增大,导电性又逐渐增强,故图中只有曲线C符合导电性变化趋势。


科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室某硫酸试剂瓶标签上的部分内容,据此下列说法正确的是( )

A.该硫酸的物质的量浓度为9.2mol/L
B.该硫酸与等体积的水混合所得溶液的质量分数等于49%
C.配制500mL4.6mol/L的稀硫酸需取该硫酸125.0mL
D.1molFe与足量的稀硫酸反应,标准状况下产生44.8L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料,而氢气、二甲醚等都是很有发展前景的新能源。
(1)在25℃、101kPa时,1gCH4完全燃烧生成液态水时放出的热量是55.64 kJ,则表示甲烷燃烧热的热化学方程式是___________________________________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ· mol-1,已知CO气体燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-565.14 kJ·mol-1,试计算相同物质的量的C3H8和CO燃烧产生的热量的比值________(保留小数点后一位)。
(3)氢气既能与氮气发生反应又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1
3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1
2NH3(g) ΔH=-92.4 kJ· mol-1
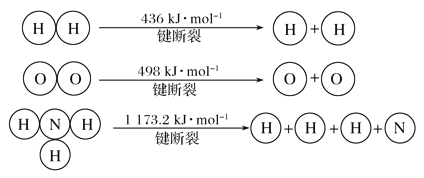
计算断裂1 mol N≡N键需要消耗能量________kJ。
(4)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.1 kJ· mol-1
②CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2=-49.0 kJ· mol-1
水煤气变换反应:③CO(g)+H2O(g)===CO2(g)+H2(g) ΔH3=-41.1 kJ· mol
二甲醚合成反应:④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ· mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:

(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知:![]() .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以![]() 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某无色溶液中只含有下列7种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-,已知该溶液与铝反应放出氢气,若反应后生成AlO2-,则溶液中一定存在的离子有______________,一定不存在的离子有______________,可能存在的离子有__________________,该溶液与铝反应放出氢气的离子方程式为_____________________________________。
(2)铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,某兴趣小组首先将其制成水溶液。
①通常将氢氧化钠溶液加入氯化亚铁溶液的实验现象是___,
②书写氢氧化亚铁在空气中转化为氢氧化铁的化学方程式___。
(3)在所得的FeCl3、CuCl2混合溶液中加入镁粉,产生的气体是___。试解释原因:___。有同学提出加入CuO以除去Fe3+。你认为理由是___。
(4)能不能直接蒸发CuCl2溶液得到CuCl2·2H2O晶体?___(填“能”或“不能”)。若能,不用回答;若不能,说明理由___。
(5)将FeCl3固体溶于蒸馏水配制溶液时常会出现浑浊,得不到澄清的氯化铁溶液,其原因是___,如果要得到澄清的氯化铁溶液,可采取的措施是___。
(6)泡沫灭火器使用NaHCO3和Al(SO4)3溶液反应产生CO2来灭火。试从平衡移动的角度分析以上两种溶液反应产生CO2的原因:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率=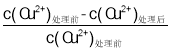 ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
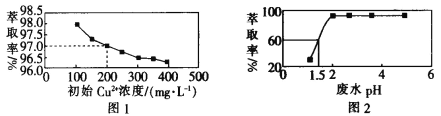
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com