
����Ŀ����ú�����ܼ�����(2���һ�����)���������������壬H2SO4 �������ᴦ����ͭ��ˮ�� ������������ͬʱ��Cu2����ȡ��[��ȡ�ʣ�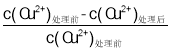 ��100�� ]���ʼ Cu2��Ũ�ȹ�ϵ��ͼ 1 ��ʾ��������������ͬʱ������ǰ��ʼ Cu2��Ũ��Ϊ 200 mg��L��1��Cu2����ȡ�����ˮ pH �Ĺ�ϵ��ͼ 2 ��ʾ������˵���������
��100�� ]���ʼ Cu2��Ũ�ȹ�ϵ��ͼ 1 ��ʾ��������������ͬʱ������ǰ��ʼ Cu2��Ũ��Ϊ 200 mg��L��1��Cu2����ȡ�����ˮ pH �Ĺ�ϵ��ͼ 2 ��ʾ������˵���������
A.����ͼ 1 ��֪����ˮ�г�ʼ Cu2��Ũ��Խ��Cu2������ȡЧ��Խ��
B.����ͼ 2 ��֪����ˮ��ʼ pH��2 ʱ��ȥ�� Cu2����Ч���Ϻ�
C.����ͼ 1 ��֪��Cu2����ʼŨ��Ϊ 200 mg��L��1 ʱ��Cu2������ȡ��Ϊ 97.0��
D.����ͼ 2 ��֪����ȡ 800 mL ��ʼ Cu2��Ũ��Ϊ 200 mg��L��1 �ķ�ˮ���� pH��1.5 ʱ������ˮ��������ķ�ˮ��ʣ�� Cu2�������ʵ���Ϊ 1.5��10��3mol(�����������)
���𰸡�AD
��������
����ͼ 1 ��֪��Cu2����ȡ�����ʼ Cu2��Ũ�ȣ�100-400mg/L�����������С������ͼ 2 ��֪����ˮ��ʼ pH��2 ʱ��ȥ�� Cu2����Ч���Ϻ����ȶ������ͼ�����ݽ��о��������
A������ͼ 1 ��֪��Cu2����ȡ�����ʼ Cu2��Ũ�ȵ��������С����A����
B������ͼ 2 ��֪����ˮ��ʼ pH��2 ʱ��ȥ�� Cu2����Ч���Ϻã���B��ȷ��
C������ͼ 1 ��֪��Cu2����ʼŨ��Ϊ 200 mg��L��1 ʱ��Cu2������ȡ��Ϊ 97.0������C��ȷ��
D������ͼ 2 ��֪����ȡ 800 mL ��ʼ Cu2��Ũ��Ϊ 200 mg��L��1 �ķ�ˮ��![]() ���� pH��1.5 ʱ������ˮ����ȡ��Ϊ60%�����ȥ��
���� pH��1.5 ʱ������ˮ����ȡ��Ϊ60%�����ȥ��![]() ��������ķ�ˮ��ʣ�� Cu2�������ʵ���Ϊ 1��10��3mol����D����
��������ķ�ˮ��ʣ�� Cu2�������ʵ���Ϊ 1��10��3mol����D����
��ѡAD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ����ƾ��壨Na2Cr2O7��2H2O���׳ƺ췯�ƣ���һ����Ҫ�Ļ�����Ʒ����FeO��Cr2O3��Na2CO3��Ϊԭ���Ʊ��췯�ƵĹ�����ͼ��ʾ��
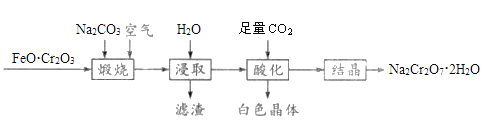
�ش���������:
��1��FeO��Cr2O3��Cr�Ļ��ϼ���__________��
��2��д�������������̷�����Ӧ�Ļ�ѧ����ʽ________________________��
��3����������Ҫ�ɷ�Ϊ________���ѧʽ����
��4�����ữ�������з�����Ӧ�����ӷ���ʽΪ_____________________________����������Ҳ�ܴﵽ���ữ��Ŀ�ģ�ѡ��CO2���ŵ���__________________________________��
��5����ȡ�췯����Ʒ1.8000g���250mL��Һ����ȡ20.00mL�ڵ���ƿ�У�����10mL��2mol��L-1H2SO4�������⻯����Һ�����Ļ�ԭ����ΪCr3+�������ڰ���5min�����������Һ��ָʾ������0.1000moL��L-1Na2S2O3����Һ�ζ���I2+2S2O32-=2I-+S4O62-�����жϴﵽ�ζ��յ��������______________________________����ʵ����ƽ������Na2S2O3����Һ25.00mL�����ظ����ƾ���Ĵ���Ϊ______________���������������������ʲ����뷴Ӧ���������4λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷��Ǻ���һ�����ᾧˮ�������������ڹ�ũҵ�����о�����Ҫ����;��ij��ѧ��ȤС����̷���һЩ���ʽ���̽�����ش��������⣺
��1�����Թ��м��������̷���Ʒ����ˮ�ܽ⣬�μ�KSCN��Һ����Һ��ɫ�����Ա仯�������Թ���ͨ���������Һ��졣�ɴ˿�֪��______________��_______________��
��2��Ϊ�ⶨ�̷��нᾧˮ��������ʯӢ�����ܣ����˿���K1��K2������Ϊװ��A�����أ���Ϊm1 g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊ m2 g������ͼ���Ӻ�װ�ý���ʵ�顣

������B��������____________________��
�ڽ�����ʵ�����������ȷ����___________________�����ţ����ظ������������裬ֱ��A���أ���Ϊm3 g��
a.��ȼ�ƾ��ƣ����� b.Ϩ��ƾ��� c.�ر�K1��K2
d.��K1��K2������ͨ��N2 e.����A f.��ȴ������
�۸���ʵ���¼�������̷���ѧʽ�нᾧˮ��Ŀx=________________����ʽ��ʾ������ʵ��ʱ��a��d�����������ʹx__________���ƫ��ƫС������Ӱ�족����
��3��Ϊ̽�����������ķֽ�������2�����Ѻ��ص�װ��A������ͼ��ʾ��װ���У���K1��K2������ͨ��N2�����ȡ�ʵ���Ӧ���в�������Ϊ��ɫ��ĩ��

��C��D�е���Һ����Ϊ_________�����ţ���C��D��������ð�������ɹ۲쵽������ֱ�Ϊ_______________��
a��Ʒ�� b��NaOH c��BaCl2 d��Ba(NO3)2 e��ŨH2SO4
��д�������������·ֽⷴӦ�Ļ�ѧ����ʽ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������г���һ������NO2��������Ӧ2NO2��g��![]() N2O4��g����H=��57 kJmol��1���¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ���ǣ�������
N2O4��g����H=��57 kJmol��1���¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ���ǣ�������
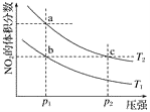
A. a��c����ķ�Ӧ���ʣ�a��cB. a��b�����ת���ʣ�a��b
C. a��c�����������ɫ��a�cdzD. ��a�㵽b�㣬�����ü��ȵķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
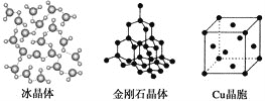
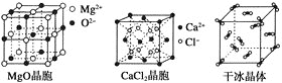
����Ŀ�����и�ͼΪ���־�����Ĺ���ʾ��ͼ��
��ش��������⣺
(1)��Щ�����У�����֮���Թ��ۼ�����γɵľ�����_______________________��
(2)�������ʯ��MgO��CaCl2���ɱ�5�־�����۵��ɸߵ��͵�˳��Ϊ_________��
(3)NaCl������MgO������ͬ��NaCl����ľ�����________(����ڡ���С�ڡ�)MgO����ľ����ܣ�ԭ����___________________________________________��
(4)ÿ��Cu������ʵ��ռ��________��Cuԭ�ӣ�CaCl2������Ca2������λ��Ϊ________��
(5)�����۵�Զ���ڸɱ�����Ҫԭ����___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������л�����![]() ��Ҫ��I2��IO3-����ʽ����
��Ҫ��I2��IO3-����ʽ����![]() ��ˮ�Ʊ����ʵ��ʵ���������£�
��ˮ�Ʊ����ʵ��ʵ���������£�

��֪����.����۵�Ϊ113�棬����̬�ĵ���Բ������ۻ�ֱ��������
��.�ֵ��к������������������ʡ�
����˵����ȷ���ǣ� ��
A.�������з�����Ӧ�����ӷ���ʽΪIO3-+3SO32-=I-+3SO42-
B.�����ٺ͢��е��л���ӷ�Һ©���϶˵���
C.����������
D.�����ݿ�����ͼ��ʾ��ˮԡװ�ý���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һˮ�ϸʰ���п��һ�ֿ������������Ӽ����ṹ��ʽ��ͼ��

��1����̬Zn2+�ļ۵����Ų�ʽΪ__��һˮ�ϸʰ���п�����漰�ķǽ���Ԫ�ص縺���ɴ�С��˳����__��
��2���ʰ��ᣨH2N-CH2-COOH����N���ӻ��������Ϊ__���ʰ���������ˮ���Դӽṹ�ǶȽ���__��
��3��һˮ�ϸʰ���п��Zn2+����λ��Ϊ__��
��4��[Zn(IMI)4](ClO4)2��Zn2+����һ������IMI�ĽṹΪ![]() ����1molIMI�к���__������
����1molIMI���__������
��5��������IMI��ij����������ʰ����γɵ����ӻ�����ΪҺ̬���ǹ�̬��ԭ����__��

��6��Zn��S�γ�ij�ֻ�����ľ�����ͼ����ʾ��
��Zn2+����S2-��ɵ�__��϶�У�����������������������������
����ͼ�����жϳ�S2-��Zn2+���У���ҪʹS2-��Zn2+���У���Zn2+�뾶Ϊ__pm����֪�����ܶ�Ϊdg/cm3��S2-�뾶Ϊapm����д�������ʽ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������½�NaOH��Һ���ӵ������ᣨH2X����Һ�У������Һ��pH������Ũ�ȱ仯�Ĺ�ϵ��ͼ��ʾ�����������������

A. Ka2��H2X����������Ϊ10-6
B. ����N��ʾpH�� �ı仯��ϵ
�ı仯��ϵ
C. NaHX��Һ��c(H��)��c(OH��)
D. �������Һ������ʱ��c(Na��)��c(HX-)��c(X2-)��c(H+)=c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�ش��������⡣
��1���������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����.��λ������![]() ��
��![]() ����ȼ��ʱ���ų�������,������ȼ��.��֪
����ȼ��ʱ���ų�������,������ȼ��.��֪![]() ��
��![]() Ϊ������Ԫ��,��ԭ�ӵĵ�һ�����ĵ��������±���ʾ:
Ϊ������Ԫ��,��ԭ�ӵĵ�һ�����ĵ��������±���ʾ:
������/ |
|
|
|
|
| 932 | 1821 | 15390 | 21771 |
| 738 | 1451 | 7733 | 10540 |
��ijͬѧ����������Ϣ,�ƶ�![]() �ĺ�������Ų���ͼ��ʾ,��ͬѧ�����ĵ����Ų�ͼΥ����_________,
�ĺ�������Ų���ͼ��ʾ,��ͬѧ�����ĵ����Ų�ͼΥ����_________, ![]() Ԫ��λ�����ڱ���������е�___ ����
Ԫ��λ�����ڱ���������е�___ ����
��![]() ���ӵ�����ԭ��
���ӵ�����ԭ��![]() ��ȡ_________�ӻ�,
��ȡ_________�ӻ�, ![]() �Ŀռ乹��Ϊ___ ��
�Ŀռ乹��Ϊ___ ��
��2��![]() ԭ�ӻ�������Χ�н϶���������Ŀչ��,����������һЩ���ӻ������γ�����
ԭ�ӻ�������Χ�н϶���������Ŀչ��,����������һЩ���ӻ������γ�����
�� ��![]() ԭ�ӻ������γ������ķ��ӻ�����Ӧ�߱��Ľṹ������____��
ԭ�ӻ������γ������ķ��ӻ�����Ӧ�߱��Ľṹ������____��
�� �������������![]() �в�����____________(����ĸ)��
�в�����____________(����ĸ)��
A.���ۼ� B.�Ǽ��Լ� C.��λ�� D. ![]() ��
��
д��һ����![]() ��Ϊ�ȵ�����ĵ��ʵķ���ʽ:________________ ��
��Ϊ�ȵ�����ĵ��ʵķ���ʽ:________________ ��
��3������![]() �Ͻ�ľ����ṹ��ͼ,��ݴ˻ش���������:
�Ͻ�ľ����ṹ��ͼ,��ݴ˻ش���������:
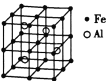
�� �úϽ�Ļ�ѧʽΪ____________��
�� ��������ܶ�Ϊ![]()
![]() ,��þ����ⳤΪ____________
,��þ����ⳤΪ____________![]() (��
(��![]() Ϊ�����ӵ�������ֵ,�ú�
Ϊ�����ӵ�������ֵ,�ú�![]() ��
��![]() �Ĵ���ʽ��ʾ,���ػ���)��
�Ĵ���ʽ��ʾ,���ػ���)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com