
【题目】重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,是一种重要的化工产品,以FeO·Cr2O3、Na2CO3等为原料制备红矾钠的工艺如图所示。
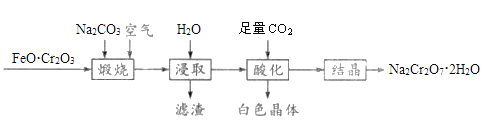
回答下列问题:
(1)FeO·Cr2O3中Cr的化合价是__________。
(2)写出“煅烧”过程发生反应的化学方程式________________________。
(3)滤渣的主要成分为________(填化学式)。
(4)“酸化”过程中发生反应的离子方程式为_____________________________,加入硫酸也能达到“酸化”目的,选择CO2的优点是__________________________________。
(5)称取红矾钠样品1.8000g配成250mL溶液,量取20.00mL于碘量瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处5min,加入淀粉溶液作指示剂,用0.1000moL·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),判断达到滴定终点的现象是______________________________。若实验中平均消耗Na2S2O3标准溶液25.00mL,则重铬酸钠晶体的纯度为______________(设整个过程中其他杂质不参与反应,结果保留4位有效数字)
【答案】+3 4FeO·Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2 Fe2O3 2Na++2CrO42-+2CO2+H2O=Cr2O72-+2NaHCO3↓ 析出的白色晶体碳酸氢钠加热后产生的Na2CO3、CO2能循环利用 滴入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色且半分钟内不恢复原色 86.23%
【解析】
制备重铬酸盐,往往需要先制得铬酸盐,在将铬酸盐酸化制得重铬酸盐:![]() 。
。
(1)FeO·Cr2O3中,氧化物可以看成是独立存在的个体,根据化合物中各元素化合价代数和为零可求得,Fe呈+2价,Cr呈+3价,O呈-2价;
(2)Na2Cr2O7·2H2O中Cr为+6价,根据流程可知FeO·Cr2O3与空气、Na2CO3煅烧后(Cr的化合价从+3价升高为+6价,Fe由+2价升高到+3价),可知生成了 Na2CrO4、Fe2O3,根据化合价升降守恒配平化学方程式:4FeO·Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2;
(3)由(2)中方程式产物可知滤渣为Fe2O3;
(4)在Na2CrO4溶液中通入CO2,生成Na2Cr2O7,白色晶体 NaHCO3,其离子方程式为:2Na++2CrO42-+2CO2+H2O=Cr2O72-+2NaHCO3↓; NaHCO3受热分解产生Na2CO3、CO2,二者都能循环利用,故选择CO2酸化更能充分利用物质;
(5)涉及的离子方程式有Cr2O72-+ 6I-+14H+=2Cr3++3I2+7H2O、且I2+2S2O3 2-=S4O62-+2I-,达到滴定终点时,滴入最后一滴Na2S2O3标准溶液,溶液由蓝色变为无色且半分钟内不恢复原色;由上述方程式可得关系式Cr2O72--3I2-6S2O32-,n(S2O32-)=25.00×10-3L×0.1000mol·L-1=2.5×10-3mol,
Cr2O72--3I2-6S2O32-
1 6
n(Cr2O72-)2 2.5×10-3mol
则n(Cr2O72-)2=2.5×10-3mol÷6=![]() ×10-3mol,所以在250mL的溶液中,n(Cr2O72-)1=
×10-3mol,所以在250mL的溶液中,n(Cr2O72-)1=![]() ×10-3mol×250mL÷20mL=
×10-3mol×250mL÷20mL=![]() ×10-3mol,则w(Na2Cr2O7·2H2O)=
×10-3mol,则w(Na2Cr2O7·2H2O)=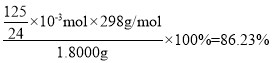
则重铬酸钠晶体的纯度为86.23%


科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3 是合成其他含钴配合物的重要原料。在活性炭的催化作用下,通过氧化二氯化六氨合钴(II)得到三氯化六氨合钴(III)制备流程如下:
![]()
资料:
①钴离子常见价态有+2(II)价,+3(III)价,Co(II)离子能在水溶液中稳定存在,但 Co(III)离子不能稳定存在,只能以固态或络合物形式(如[Co(NH3)6]3+)稳定存在溶液中。
② Co2+在 pH=9.4 时完全沉淀为 Co(OH)2
(1) 实验中需要将 CoCl2·6H2O 晶体研细,其目的是:__________________。
(2)在加入浓氨水前先加入大量 NH4Cl溶液,请结合平衡原理解释原因______________________。
(3)在“氧化”过程中需水浴控温在 50~60℃,温度不能过高,原因是______________________。
(4)写出“氧化”过程中反应的离子方程式_______________。
(5)为测定产品中钴的含量,进行下列实验:
①称取样品 4.000 g 于烧瓶中,加水溶解,加入足量的 NaOH 溶液,加热至沸 15~20 min,将 [Co(NH3)6]Cl3 完全转化为 Co(OH)3,冷却后加入足量 KI 固体和 HCl 溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至 250.00 mL 容量瓶中,加水定容,取其中 25.00 mL 试样加入到锥形瓶中;
②用 0.100 0 mol·L -1 Na2S2O3 标准溶液滴定,溶液变为浅黄色后,加入淀粉溶液作指示剂继续滴定至终点,重复 2 次实验,测得消耗 Na2S2O3 溶液的平均体积为 15.00 mL。(已知:2Co3++2I-=2Co2++I2 ,I2 +2S2O32-=2I-+S4O62-).通过计算确定该产品中钴的含量___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a 、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近均有气泡产生;铜珠n的右侧有气泡产生。 |
下列对实验现象的解释或推测不合理的是( )
A. 根据实验一的原理,实验二中铜珠m左侧变厚
B. a、d处:2H2O+2e-=H2↑+2OH-
C. b处:2Cl--2e-=Cl2↑;Cl2 + H2O =HCl + HClO
D. c处发生了反应:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | __ | __ | __ | __ |
① ![]() 与
与![]() ②
② ![]() 与
与![]() ③金刚石和石墨 ④12C、13C、14C ⑤
③金刚石和石墨 ④12C、13C、14C ⑤![]() 和
和![]()
II.下图中A、B、C 分别是三种烃的结构模型:

请回答下列问题:
(1)A 的电子式______________,B 的结构简式________________。
(2)A及其同系物的分子式符合通式_____________(用 n 表示)。当 n=____________时,烷烃开始出现同分异构体;当 n=6 时,同分异构体有__________种。
(3)A、B、C 三种有机物中,所有原子均共面的是___________(填名称)。结构简式为 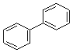 的有机物中,处于同一平面内的原子数最多为__________,处于 同一平面内的碳原子数至少为____________。
的有机物中,处于同一平面内的原子数最多为__________,处于 同一平面内的碳原子数至少为____________。
(4)有机物 C 不具有的结构或性质是_____________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构 b.有毒、不溶于水、密度比水小
c.不能使酸性 KMnO4 溶液和溴水反应褪色 d.一定条件下能与氢气或氧气反应
(5)等质量的三种有机物完全燃烧生成 H2O 和 CO2,消耗氧气的体积(相同状况下)最大的是_______(填A 或B 或 C)。
III.某有机物的结构简式如图,1mol 该有机物最多可以和______mol氢气反应,最多可以和_____molNaOH 反应。
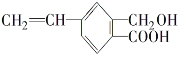
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:

(1)装置I中仪器甲的名称是___________。
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。
(3)装置Ⅱ中的试剂X是___________。
(4)装置Ⅲ中搅拌的目的是___________。
(5)上述炭置按气流由左至右各接口顺序为___________(用字母表示)。
(6)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:___________。
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O
KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O
I2+2Na2S2O3===2NaI+N2S4O6
则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 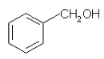 与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 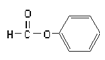 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代陶瓷烧制工艺的珍品“唐三彩”中的蓝色,其釉料的着色剂是一种含钴矿物。钴在制取颜料和制备合金方面有着重要的应用,回答下列问题。
(1)基态Co2+的核外电子排布式为__________,基态Co原子中空间运动状态不同的电子数为___种。
(2)配合物[Co(NH3)5Br](NO3)2中存在的化学键类型有__________,配体NH3中配位原子的杂化轨道类型为__________,NO3-的空间构型是__________,第一电离能N__________(填“大于”或“小于”)O。
(3)CoO2具有如图所示的层状结构(小球表示Co,大球表示O)。下列用粗实线画出的结构单元不能描述其化学组成的是__________(填字时代号)。
A.  B.
B. 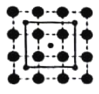 C.
C. 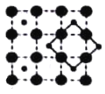 D.
D. 
(4)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________ nm(结果保留三位小数,下同)。CoO也属于NaCl型结构,晶胞参数为a'=0.488 nm,则r(Co2+)为________ nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是

A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率=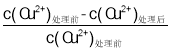 ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
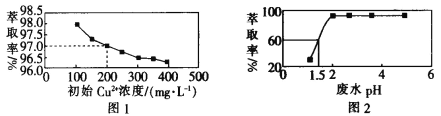
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com