
【题目】中国古代陶瓷烧制工艺的珍品“唐三彩”中的蓝色,其釉料的着色剂是一种含钴矿物。钴在制取颜料和制备合金方面有着重要的应用,回答下列问题。
(1)基态Co2+的核外电子排布式为__________,基态Co原子中空间运动状态不同的电子数为___种。
(2)配合物[Co(NH3)5Br](NO3)2中存在的化学键类型有__________,配体NH3中配位原子的杂化轨道类型为__________,NO3-的空间构型是__________,第一电离能N__________(填“大于”或“小于”)O。
(3)CoO2具有如图所示的层状结构(小球表示Co,大球表示O)。下列用粗实线画出的结构单元不能描述其化学组成的是__________(填字时代号)。
A.  B.
B. 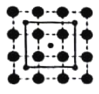 C.
C. 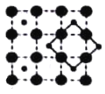 D.
D. 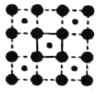
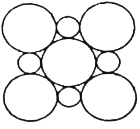
(4)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________ nm(结果保留三位小数,下同)。CoO也属于NaCl型结构,晶胞参数为a'=0.488 nm,则r(Co2+)为________ nm
【答案】1s22s22p63s23p63d7(或Ar[3d7]) 15 离子键、共价键、配位键 sp3 平面(正)三角形 大于 D 0.148 0.076
【解析】
(1)Co为第27号元素,Co2+的核外电子排布式为1s22s22p63s23p63d7(或Ar[3d7]),空间运动状态即核外电子占有的不同能级,Co的核外电子排布式为1s22s22p63s23p63d74s2,共有4个s能级,2个p能级,1个d能级,s能级一个形状,p能级3个形状,d能级5个形状,所以基态Co原子中空间运动状态不同的电子数为4+2×3+5=15;
(2)物质[Co(NH3)5Br](NO3)2为配位化合物,其存在的化学键类型有:共价键、离子键、配位键;配体NH3中中心原子为N原子,根据VSEPR模型计算,N原子周围有4个电子对,故N原子的杂化方式为sp3杂化;根据VSEPR模型计算,NO3-的空间构型为平面正三角形;氮元素的2p轨道电子处于半充满稳定状态,N元素的第一电离能大于O元素。
(3)根据粗实线所画的结构单元可以算出,A图中:每条粗实线上有1个O原子,这个氧原子属于两个结构单元,故一个结构单元中共有2个O原子和1个Co原子;B图中:两条粗实线的交点上有一个Co原子,这个Co原子被4个结构单元共有,故一个结构单元中有2个O原子和1个Co原子;C图中:两条粗实线的交点是Co原子,被4个结构单元共有,粗实线上有1个O原子,被两个结构单元公用,故一个结构单元中有2个O原子和1个Co原子;D图中两条粗实线的交点为O原子,被4个结构单元公用,结构单元中有1个Co原子,故一个结构单元中1个O原子和1个Co原子,故答案为D;
(4)MgO晶胞:大圆代表O2-,小圆代表Mg2+,晶胞参数为0.420nm,晶胞的面对角线长为![]() =0.594nm,对角线上是4个O2-的半径长度,故r(O2-)=0.148nm;CoO晶胞:CoO的晶胞参数为0.488nm,晶胞参数是由2个O2-半径和1和Co2+直径组成,故r(Co2+)=0.076nm。
=0.594nm,对角线上是4个O2-的半径长度,故r(O2-)=0.148nm;CoO晶胞:CoO的晶胞参数为0.488nm,晶胞参数是由2个O2-半径和1和Co2+直径组成,故r(Co2+)=0.076nm。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 ![]() H+ +HO2-,HO2-
H+ +HO2-,HO2- ![]() H+ +O22-。
H+ +O22-。
编号 | 实验 | 现象 |
Ⅰ | 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出现少量气泡 |
Ⅱ | 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
Ⅲ | 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=__,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:__(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物M(Rolumilast)能用于慢性阻塞性肺病的治疗,其一种合成路线如图:
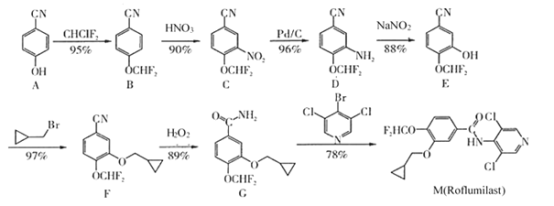
注:箭头下的百分数为每步反应的产率。
(1)化合物A中含氧官能团的名称是__;B→C的反应类型为__。
(2)由E→F的化学方程式为__。
(3)在G→M的过程中,若使用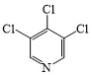 代替
代替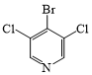 ,则M的产率会由78%降至48%,其原因除了氯原子的反应活性比溴原子低外,还可能是__。
,则M的产率会由78%降至48%,其原因除了氯原子的反应活性比溴原子低外,还可能是__。
(4)按上述合成路线,若投入0.01mol化合物D参与反应,最终获得化合物F(摩尔质量:239g·mol-1)的质量为___g。
(5)化合物M的另一种合成路线如图:
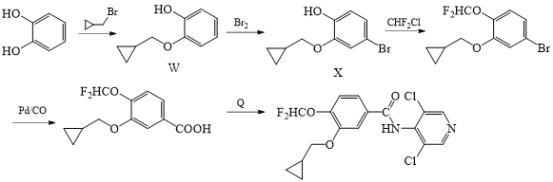
回答下列问题:
①化合物X的分子式为__。
②写出化合物Q的结构简式__。
③写出同时符合下列条件的化合物W的同分异构体的__(写出一种即可)。
Ⅰ.能与FeCl3溶液发生显色反应
Ⅱ.苯环上的一氯代物只有一种
Ⅲ.核磁共振氢谱有5组峰且峰面积之比为1:1:2:2:6
查看答案和解析>>
科目:高中化学 来源: 题型:
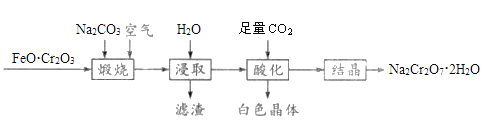
【题目】重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,是一种重要的化工产品,以FeO·Cr2O3、Na2CO3等为原料制备红矾钠的工艺如图所示。
回答下列问题:
(1)FeO·Cr2O3中Cr的化合价是__________。
(2)写出“煅烧”过程发生反应的化学方程式________________________。
(3)滤渣的主要成分为________(填化学式)。
(4)“酸化”过程中发生反应的离子方程式为_____________________________,加入硫酸也能达到“酸化”目的,选择CO2的优点是__________________________________。
(5)称取红矾钠样品1.8000g配成250mL溶液,量取20.00mL于碘量瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处5min,加入淀粉溶液作指示剂,用0.1000moL·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),判断达到滴定终点的现象是______________________________。若实验中平均消耗Na2S2O3标准溶液25.00mL,则重铬酸钠晶体的纯度为______________(设整个过程中其他杂质不参与反应,结果保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某液有机物A的分子组成,取6.9 g A使之与过量O2燃烧,生成物依次通入足量的浓硫酸和碱石灰,测得浓硫酸增重8.1 g,碱石灰增重13.2 g。又测得A的蒸汽密度是相同条件下氢气密度的23倍,试通过计算来确定A的分子式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图,
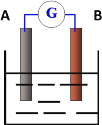
(1)若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为________极 (填正或负),写出电极反应式:正极____________负极_________________。
(2)若A为Zn,B为Cu,电解质溶液为稀硫酸,则A电极名称为 _________,写出正极的电极反应式___________。
(3)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47g,试计算产生标准状况氢气的体积为多少L?(请写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() =1×10-12的溶液中:K+、
=1×10-12的溶液中:K+、![]() 、
、![]() 、
、![]()
C.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.能使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图:

(1)基态Zn2+的价电子排布式为__;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是__。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为__;甘氨酸易溶于水,试从结构角度解释__。
(3)一水合甘氨酸锌中Zn2+的配位数为__。
(4)[Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1molIMI中含有__σ键。
,则1molIMI中含有__σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物为液态而非固态,原因是__。

(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
①Zn2+填入S2-组成的__空隙中(填“四面体”或“八面体”);
②由图不能判断出S2-、Zn2+相切,若要使S2-、Zn2+相切,则Zn2+半径为__pm,已知晶体密度为dg/cm3,S2-半径为apm。(写计算表达式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com