
【题目】根据所学知识回答下列问题。
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的![]() 和
和![]() 单质燃烧时均放出大量热,可用作燃料.已知
单质燃烧时均放出大量热,可用作燃料.已知![]() 和
和![]() 为短周期元素,其原子的第一至第四电离能如下表所示:
为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/ |
|
|
|
|
| 932 | 1821 | 15390 | 21771 |
| 738 | 1451 | 7733 | 10540 |
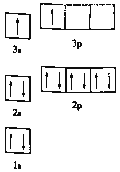
①某同学根据上述信息,推断![]() 的核外电子排布如图所示,该同学所画的电子排布图违背了_________,
的核外电子排布如图所示,该同学所画的电子排布图违背了_________, ![]() 元素位于周期表五个区域中的___ 区。
元素位于周期表五个区域中的___ 区。
②![]() 分子的中心原子
分子的中心原子![]() 采取_________杂化,
采取_________杂化, ![]() 的空间构型为___ 。
的空间构型为___ 。
(2)![]() 原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
① 与![]() 原子或离子形成配合物的分子或离子应具备的结构特征是____。
原子或离子形成配合物的分子或离子应具备的结构特征是____。
② 六氰合亚铁离子![]() 中不存在____________(填字母)。
中不存在____________(填字母)。
A.共价键 B.非极性键 C.配位键 D. ![]() 键
键
写出一种与![]() 互为等电子体的单质的分子式:________________ 。
互为等电子体的单质的分子式:________________ 。
(3)—种![]() 合金的晶胞结构如图,请据此回答下列问题:
合金的晶胞结构如图,请据此回答下列问题:
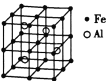
① 该合金的化学式为____________。
② 若晶体的密度为![]()
![]() ,则该晶胞棱长为____________
,则该晶胞棱长为____________![]() (设
(设![]() 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含![]() 和
和![]() 的代数式表示,不必化简)。
的代数式表示,不必化简)。
【答案】能量最低原理s![]() 直线形具有孤对电子B
直线形具有孤对电子B![]()
![]()
![]()
【解析】
(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,2p能级的轨道内有自旋方向相同的2个电子,所以违背能量最低原理与泡利原理.由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2,处于周期表中s区,故答案为:能量最低原理;s;
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型,故答案为:sp;直线;
(2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,故答案为:具有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键,所以CN-中共价键、配位键、σ键、π键;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质为N2,故答案为:B;N2;
(3)①由晶胞图示可知,晶胞中含有4个Al原子,且都位于晶胞内部,则晶胞平均含有4个Al,晶胞中Fe位于顶点的有8个,位于面心的有6个,位于棱上的有12个,位于体心的有1个,含有Fe原子数目为8×![]() +6×
+6×![]() +12×
+12×![]() +1=8,Fe与 Al原子数目之比为8:4=2:1,故该合金的化学式为Fe2Al,故答案为:Fe2Al;
+1=8,Fe与 Al原子数目之比为8:4=2:1,故该合金的化学式为Fe2Al,故答案为:Fe2Al;
②一个晶胞中含有8个Fe原子和4个Al原子,晶胞的质量为![]() g,棱长为
g,棱长为![]() ,故答案为:
,故答案为:![]() 。
。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率=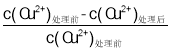 ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
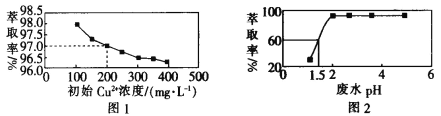
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据如表所示:
溶解度/(g/100g水)
0 | 20 | 40 | 60 | 80 | 100 | |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
溶度积常数
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为______,电池反应的离子方程式为____
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn_____g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和______,欲从中得到较纯的MnO2,最简便的方法是_____________,其原理是_______/span>。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生反应生成中间体Fe。下列说法不正确的是
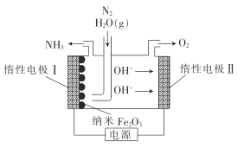
A.惰性电极II是电解池的阳极,发生氧化反应
B.生成氨气的反应:2Fe+N2+3H2O=Fe2O3+2NH3
C.惰性电极I的电极反应:Fe2O3+3H2O+6e -=2Fe+ 6OH-
D.产生2.24LO2时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一种蓝色晶体,可表示为MxFey(CN)6,经X 射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如下图所示。下列说法中正确的是( )
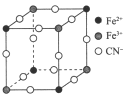
A. 该晶体的化学式为MFe2(CN)6
B. 该晶体属于离子晶体,M呈+3价
C. 该晶体属于离子晶体,M呈+2价
D. 晶体中与每个Fe3+距离最近且等距离的CN-为3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种可溶性盐,阳离子分别可能是Ba2+、Na+、Ag+、Cu2+中的某一种,阴离子分别可能是![]() 中的某一种。
中的某一种。
(1) C的溶液呈蓝色,向这四种盐溶液中分别加盐酸,B盐有沉淀产生,D盐有无色无味气体逸出。则它们的化学式应为:
A_______,B_______,C_______,D_______。
(2)写出下列反应的离子方程式:
①A+C__________________________。
②D+盐酸________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
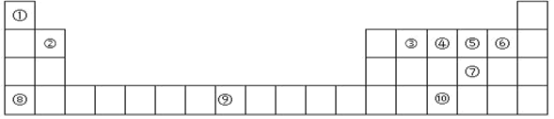
(1)在①~⑩元素的电负性最大的是_____(填元素符号)。
(2)⑨元素有_____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布图为_____。
(4)⑤的氢化物与⑦的氢化物比较稳定的是_____,沸点较高的是_____(填化学式)。
(5)上述所有元素中的基态原子中 4p轨道半充满的是_____(填元素符号),4s轨道半充满的是_____(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A. 羟基的电子式:![]()
B. 甘氨酸的结构简式:C2H5NO2
C. AlCl3溶液中Al3+水解的离子方程式:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
D. 粗铜(含Cu及少量Zn、Fe、Ag等)电解精炼时,阳极主要发生反应:Ag-e-=Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H[3-亚甲基异苯并呋喃-1(3H)-酮]的一种合成路线如下:
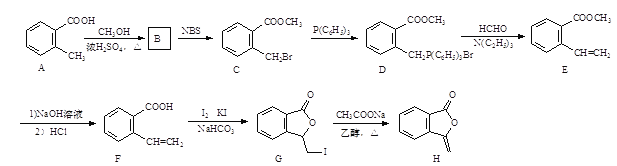
(1)C中所含官能团名称为_________和_________。
(2)G生成H的反应类型是________。
(3)B的分子式为C9H10O2,写出B的结构简式:________。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。①分子中含有苯环,能使Br2的CCl4溶液褪色;
②碱性条件水解生成两种产物,酸化后分子中均只有4种不同化学环境的氢,其中之一能与FeCl3溶液发生显色反应。
(5)写出以![]() 、P(C6H5)3及N(C2H5)3为原料制备
、P(C6H5)3及N(C2H5)3为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com