
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
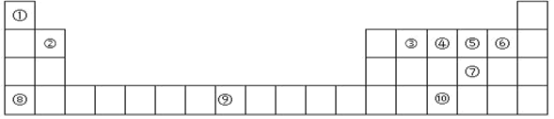
(1)在①~⑩元素的电负性最大的是_____(填元素符号)。
(2)⑨元素有_____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布图为_____。
(4)⑤的氢化物与⑦的氢化物比较稳定的是_____,沸点较高的是_____(填化学式)。
(5)上述所有元素中的基态原子中 4p轨道半充满的是_____(填元素符号),4s轨道半充满的是_____(填元素符号)。
【答案】F 26 ![]() H2O H2O As K
H2O H2O As K
【解析】
根据元素在元素周期表中的位置可知,①为H元素;②为Be元素;③为C元素;④为N元素;⑤为O元素;⑥为F元素;⑦为S元素;⑧为K元素;⑨为Fe元素;⑩为As元素。结合元素周期律和原子结构分析解答。
根据元素在元素周期表中的位置可知,①为H元素;②为Be元素;③为C元素;④为N元素;⑤为O元素;⑥为F元素;⑦为S元素;⑧为K元素;⑨为Fe元素;⑩为As元素。
(1)元素的非金属性越强,电负性数值越大,在①~⑩元素的电负性最大的是F,故答案为:F;
(2) ⑨为Fe元素,为26号元素,原子中没有运动状态完全相同的2个电子,铁原子中有26种运动状态不同的电子,故答案为:26;
(3)⑩为As元素,为33号元素,与N同主族,基态原子的价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(4) ⑤为O元素,⑦为S元素,元素的非金属性越强,气态氢化物的稳定性越强,氢化物比较稳定的是H2O;水分子间能够形成氢键,沸点比硫化氢高,沸点较高的是H2O,故答案为:H2O;H2O;
(5)上述所有元素中的基态原子中 4p 轨道半充满的是As,4s轨道半充满的是K,故答案为:As;K。


科目:高中化学 来源: 题型:
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图:

(1)基态Zn2+的价电子排布式为__;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是__。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为__;甘氨酸易溶于水,试从结构角度解释__。
(3)一水合甘氨酸锌中Zn2+的配位数为__。
(4)[Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1molIMI中含有__σ键。
,则1molIMI中含有__σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物为液态而非固态,原因是__。

(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
①Zn2+填入S2-组成的__空隙中(填“四面体”或“八面体”);
②由图不能判断出S2-、Zn2+相切,若要使S2-、Zn2+相切,则Zn2+半径为__pm,已知晶体密度为dg/cm3,S2-半径为apm。(写计算表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() ),下列叙述完全正确的是( )
),下列叙述完全正确的是( )
①能使酸性 KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯中;⑤苯环能与溴水发生取代反应;⑥可与 H2 发生加成反应,最多需要4molH2
A. ①②③B. ①②④⑥
C. ①②④⑤⑥D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题。
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的![]() 和
和![]() 单质燃烧时均放出大量热,可用作燃料.已知
单质燃烧时均放出大量热,可用作燃料.已知![]() 和
和![]() 为短周期元素,其原子的第一至第四电离能如下表所示:
为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/ |
|
|
|
|
| 932 | 1821 | 15390 | 21771 |
| 738 | 1451 | 7733 | 10540 |
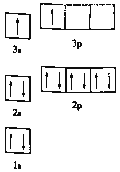
①某同学根据上述信息,推断![]() 的核外电子排布如图所示,该同学所画的电子排布图违背了_________,
的核外电子排布如图所示,该同学所画的电子排布图违背了_________, ![]() 元素位于周期表五个区域中的___ 区。
元素位于周期表五个区域中的___ 区。
②![]() 分子的中心原子
分子的中心原子![]() 采取_________杂化,
采取_________杂化, ![]() 的空间构型为___ 。
的空间构型为___ 。
(2)![]() 原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
① 与![]() 原子或离子形成配合物的分子或离子应具备的结构特征是____。
原子或离子形成配合物的分子或离子应具备的结构特征是____。
② 六氰合亚铁离子![]() 中不存在____________(填字母)。
中不存在____________(填字母)。
A.共价键 B.非极性键 C.配位键 D. ![]() 键
键
写出一种与![]() 互为等电子体的单质的分子式:________________ 。
互为等电子体的单质的分子式:________________ 。
(3)—种![]() 合金的晶胞结构如图,请据此回答下列问题:
合金的晶胞结构如图,请据此回答下列问题:
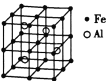
① 该合金的化学式为____________。
② 若晶体的密度为![]()
![]() ,则该晶胞棱长为____________
,则该晶胞棱长为____________![]() (设
(设![]() 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含![]() 和
和![]() 的代数式表示,不必化简)。
的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是( )
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则体积变为原来的![]()
D.反应中消耗的氧气为1.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
4 |
(1)请画出元素⑨阴离子的结构示意图:________________________________。
(2)③⑤⑧的原子半径由小到大的顺序为________(填元素符号)。
(3)⑤和⑦的最高价氧化物对应水化物的碱性强弱为______>______(填化学式)。
(4)③⑤两种元素的原子按1∶1组成的常见化合物的电子式为__________。
(5)用电子式表示⑥和⑨形成的化合物的过程:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律。
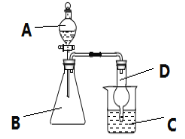
(1)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液___的现象,即可证明。从环保角度考虑,此装置缺少尾气处理装置,可用___溶液吸收尾气。请写出一种制氯气的化学反应方程式:___。
(2)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液___的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有___溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 浓度均为
浓度均为![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 的
的![]() ,测得混合溶液的电阻率(溶液的电阻率越大,导电能力越弱)与加入氨水的体积
,测得混合溶液的电阻率(溶液的电阻率越大,导电能力越弱)与加入氨水的体积![]() 的关系如图所示(忽略混合时体积变化),下列说法正确的是( )
的关系如图所示(忽略混合时体积变化),下列说法正确的是( )

A.常温下,![]() 的
的![]() 比同浓度
比同浓度![]() 的
的![]() 大
大
B.![]() 过程中水的电离程度先减小后增大
过程中水的电离程度先减小后增大
C.![]() 点溶液中,
点溶液中,![]()
D.![]() 点时,
点时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
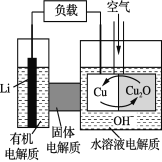
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com