
【题目】有如下反应(未配平):BrF3+H2O→Br2+O2+HBrO3+HF,反应后测得生成Br2与O2各1 mol。下列判断错误的是
A.反应共转移6 mol电子
B.氧化剂为BrF3,还原产物为Br2
C.配平后H2O与HF的物质的量之比为5∶9
D.被水还原的BrF3与被自身还原的BrF3的物质的量之比是1∶2
【答案】D
【解析】
反应BrF3+H2O→HBrO3+Br2+HF+O2↑中,溴元素的化合价由+3价变为+5价和0价,所以部分氟化溴失电子部分得电子,则氟化溴既是氧化剂又是还原剂,氧元素的化合价部分由-2价变为0价,所以部分水作还原剂,根据电子守恒,配平后的方程式如下:3BrF3+5H2O=HBrO3+Br2+O2+9HF,单线桥表示电子转移情况: ,以此来解答。
,以此来解答。
A. 由分析可知,单线桥表示该反应电子转移情况为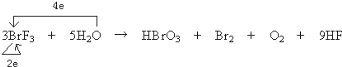 ,反应共转移2+4=6 mol电子,故A正确;
,反应共转移2+4=6 mol电子,故A正确;
B. 反应BrF3+H2O→HBrO3+Br2+HF+O2↑中,溴元素的化合价由+3价变为+5价和0价,氧化剂是BrF3,还原产物是Br2,故B正确;
C. 由分析可知配平后的方程式为:3BrF3+5H2O=HBrO3+Br2+O2+9HF,H2O与HF的物质的量之比为5∶9,故C正确;
D. 配平后的方程式:3BrF3+5H2O=HBrO3+Br2+O2+9HF,当有5.0mol水参加反应时,3molBrF3参与反应,反应共转移6 mol电子,水作还原剂,共有2mol水失去4mol电子,BrF3中作还原剂部分Br元素由+3价变为+5价,需要失去6mol-4mol=2mol电子,则作还原剂的BrF3的物质的量为1mol,作氧化剂的BrF3为2mol,被水还原的BrF3与被自身还原的BrF3的物质的量之比是2∶1,故D错误;
题目要求选错误的,故选D。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】向盛有氯气的三个集气瓶中,分别注入约五分之一的液体并振荡,观察下图所记录的现象,其中判断各瓶所注入的液体正确的是( )

A. ①中为硝酸银溶液B. ②中为氢氧化钠溶液
C. ③中为蒸馏水D. ③中为澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
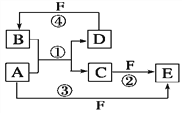
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为____________________________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是_____________________________________ ,已知光照条件下D与F反应生成B,写出该反应的化学方程式:______________________________________
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水质量是关系人类健康的重要问题。
(1)Cl2是最早用于饮用水消毒的物质,写出Cl2溶于水发生反应的离子方程式________________。
(2)C1O2是一种高效、低毒的消毒剂,逐渐取代Cl2成为生产自来水的消毒剂。KClO3与SO2在强酸性溶液中反应可制得C1O2,此反应的离子方程式为_________________。ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为___________。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、ClO2氧化性更强,无二次污染的绿色水处理剂。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。由以上信息可知,相同条件下,高铁酸钠溶解度比高铁酸钾溶解度______ (填“大”或“小”)。干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应每生成1 molNa2FeO4转移____mol电子。
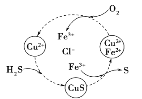
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是_______。该图示的总反应为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,3.4 g NH3中含有的电子数为0.2NA
B.1 mol·L-1的Fe2(SO4)3溶液中,含有的SO42-数目为3NA
C.标准状况下,22.4 L CO2和O2的混合气体中含氧原子数为2NA
D.1 mol Fe在纯氧中完全燃烧,生成Fe3O4,Fe失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型绿色消毒剂,其在消毒(发生氧化还原反应)后可形成Fe(OH)3胶体,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
(1)干法制备高铁酸钾时,先制备得到Na2FeO4,反应如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中,氧化剂是________,氧化产物是________。
②每生成1 mol Na2FeO4,转移________mol电子。
(2)配平湿法制备高铁酸钾反应的离子方程式:
______Fe(OH)3+______ClO-+______OH-===______FeO42-+______Cl-+______H2O
(3)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,该反应表明氧化性:K2FeO4______(填“>”或“<”)Cl2。
(4)Fe(OH)3胶体可使水中悬浮物沉降下来,用作净水剂。
①实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是_____________________。
②下列有关胶体的说法不正确的是________(填字母代号)。
a.光束通过Fe(OH)3胶体时形成光亮的“通路”
b.往Fe(OH)3胶体中加入稀硫酸,先出现红褐色沉淀,后沉淀溶解消失
c.Fe(OH)3胶体粒子不能透过滤纸,能透过半透膜
d.Fe(OH)3胶体发生电泳时,其胶体粒子向阴极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题:
(1)标准状况下,___gCO和4.48LCO2所含的分子数目相同,两种气体的碳原子数之和为___。
(2)将标况下6.72LHCl气体溶于水,配成100mL溶液,得到物质的量浓度为___的盐酸溶液。
(3)已知8gA与32gB恰好完全反应,只生成0.5molC和18gD,则C的摩尔质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物,“速力菲”(主要成分为的琥珀酸亚铁,即丁二酸亚铁)是市场上一种常用的补铁药物,它难溶于水,但在人体胃酸的作用下可以释放出Fe2+,从而被人体吸收。
(1)某同学为了检验其中的Fe2+,将药物研磨、水溶后过滤。
①如图是某学生的过滤操作示意图,其操作不规范的是___(填标号)

a.玻璃棒用作引流
b.漏斗末端颈尖未紧靠烧杯壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中搅动以加快过滤速度
②取少量所得滤液,分别加入 K3Fe(CN)6溶液(一种检验Fe2+的试剂)和KSCN溶液(一种检验Fe3+的试剂),均未出现明显现象。其主要原因是___。
(2)取酸性环境下“速力菲”溶解过滤后的滤液敞口放置在空气中一段时间,然后滴入KSCN溶液,溶液立即呈现血红色说明有Fe3+生成,说明Fe2+___。
(3)医生通常会建议:与维生素C同时服用,能增强“速力菲”的补铁效果。此举是利用了维生素C的___。(填“氧化性”、“还原性”或“碱性”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量之比为1∶2的是( )
A. 3S+6NaOH===2Na2S+Na2SO3+3H2O
B. 2CH3COOH+Ca(ClO)2===2HClO+Ca(CH3COO)2
C. 4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D. I2+2NaClO3===2NaIO3+Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com