
【题目】高铁酸钾(K2FeO4)是一种新型绿色消毒剂,其在消毒(发生氧化还原反应)后可形成Fe(OH)3胶体,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
(1)干法制备高铁酸钾时,先制备得到Na2FeO4,反应如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中,氧化剂是________,氧化产物是________。
②每生成1 mol Na2FeO4,转移________mol电子。
(2)配平湿法制备高铁酸钾反应的离子方程式:
______Fe(OH)3+______ClO-+______OH-===______FeO42-+______Cl-+______H2O
(3)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,该反应表明氧化性:K2FeO4______(填“>”或“<”)Cl2。
(4)Fe(OH)3胶体可使水中悬浮物沉降下来,用作净水剂。
①实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是_____________________。
②下列有关胶体的说法不正确的是________(填字母代号)。
a.光束通过Fe(OH)3胶体时形成光亮的“通路”
b.往Fe(OH)3胶体中加入稀硫酸,先出现红褐色沉淀,后沉淀溶解消失
c.Fe(OH)3胶体粒子不能透过滤纸,能透过半透膜
d.Fe(OH)3胶体发生电泳时,其胶体粒子向阴极移动
【答案】Na2O2 Na2FeO4和O2 5 2 3 4 2 3 5 > FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl c
Fe(OH)3(胶体)+3HCl c
【解析】
(1)①分析反应2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑中元素化合价变化可以解答;
②反应2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑中元素化合价变化较多,由降低O元素计算方便;
(2)湿法制备高铁酸钾(K2FeO4),结合物质的性质可知,氢氧化铁被氧化;
(3)由氧化剂的氧化性大于氧化产物的氧化性可得答案;
(4)①实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
②根据胶体的性质解答。
(1)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑中Fe元素的化合价升高,O元素的化合价既升高又降低,则氧化剂为Na2O2,还原剂为FeSO4和Na2O2;
②2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑中Fe元素的化合价升高,O元素的化合价既升高又降低,由降低O元素可知每生成1molNa2FeO4转移的电子数为1mol×5×(2-1)=5mol;
(2)湿法制备高铁酸钾(K2FeO4),结合物质的性质可知,氢氧化铁被氧化,该离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
(3)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,方程式为:2K2FeO4+16HCl=4KCl+2FeCl3+8H2O+3Cl2↑,该反应中K2FeO4中Fe元素化合价降低是氧化剂,HCl中Cl元素化合价升高是还原剂生成氧化产物Cl2,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:K2FeO4>Cl2;
(4)①实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
②a. 胶体能发生丁达尔效应,故a正确;
b. 向胶体中加入电解质溶液发生聚沉,氢氧化铁与过量的稀硫酸发生化学反应而溶解,故b正确;
c. 胶体粒子的大小在1-100nm之间,可以透过滤纸但不能透过半透膜,故c错误;
d. 氢氧化铁胶体具有吸附性,吸附阳离子,则胶体粒子带电,在电场作用下氢氧化铁胶粒会移向阴极,阴极附近颜色变深,会产生电泳现象,故d正确;说法不正确的是c。


科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaClO2的实验流程如图所示,反应I中发生的反应为3NaClO3+4SO2+3H2O====2ClO2+Na2SO4+3H2SO4+NaCl,下列说法中正确的是

A. 反应Ⅱ中H2O2做还原剂
B. 产品中含有SO42-、Cl-
C. NaClO2的漂白原理与SO2相同
D. 实验室进行结晶操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物VL (标准状况),溶于mg水中,得到质量分数为w、 物质的量浓度为c mol/L、密度为g/mL的溶液,下列说法正确的是( )
A.相对分子质量 M=22.4mω/(1-ω)V
B.物质的量浓度c=ρv/(MV+22.4m)
C.溶液的质量分数ω=MV/22.4m
D.溶液密度ρ=cω/1000ρω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下反应(未配平):BrF3+H2O→Br2+O2+HBrO3+HF,反应后测得生成Br2与O2各1 mol。下列判断错误的是
A.反应共转移6 mol电子
B.氧化剂为BrF3,还原产物为Br2
C.配平后H2O与HF的物质的量之比为5∶9
D.被水还原的BrF3与被自身还原的BrF3的物质的量之比是1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol/L 的硫酸溶液:Ba2+、Ag+、SO32-、CH3COO-
B.能使石蕊试液变红的溶液:Ca2+、NH4+、Cl-、NO3-
C.无色透明溶液:K+、Cu2+、I-、CO32-
D.离子浓度均为0.1mol/L 的溶液:Na+、Ba2+、HCO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
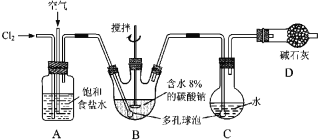
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是________________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是____________________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用_____取20.00 mL次氯酸溶液,加入足量的_________________,再加入足量的_______________,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

已知:
①酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性。
②CeO2不溶于稀硫酸。
③硫酸铁铵[aFe2(SO4)3b(NH4)2SO4cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂B的是 (填序号)。
a.NaClO b.H2O2 c.KMnO4
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是 。
(3)写出反应②的化学方程式 。
(4)用滴定法测定制得的Ce(OH)4产品纯度。称取Ce(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4溶液滴定,所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com