
【题目】相对分子质量为M的气态化合物VL (标准状况),溶于mg水中,得到质量分数为w、 物质的量浓度为c mol/L、密度为g/mL的溶液,下列说法正确的是( )
A.相对分子质量 M=22.4mω/(1-ω)V
B.物质的量浓度c=ρv/(MV+22.4m)
C.溶液的质量分数ω=MV/22.4m
D.溶液密度ρ=cω/1000ρω
科目:高中化学 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A. 2:1:1
B. 1:1:2
C. 1:2:1
D. 4:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在25 oC 101KPa时
①1g氢气完全燃烧生成气态水放出120.9 KJ的热量
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
③Na2O2(s)+CO2(g)=Na2CO3(s)+![]() ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
在相同条件下根据以上信息回答下列问题:
(1)请书写氢气完全燃烧生成气态水的热化学方程式_______________________________。
(2)CO的燃烧热为ΔH=_____。
(3)请写出Na2O2(s)与CO(g)反应生成Na2CO3(s)的热化学方程式_______________________。
(4)请计算CO(g)与Na2O2(s)反应放出1018kJ热量时,转移电子的物质的量__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
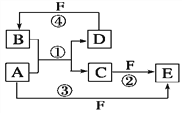
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为____________________________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是_____________________________________ ,已知光照条件下D与F反应生成B,写出该反应的化学方程式:______________________________________
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2L NO2完全溶于水,转移电子数为0.5NA
B.20g D2O和HTO两种水的组合中含有的中子数为10NA
C.一定温度下,lmol H2和足量碘蒸气反应产生的H-I键数目为2NA
D.标准状况下,22.4L的SO3中含有的O原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水质量是关系人类健康的重要问题。
(1)Cl2是最早用于饮用水消毒的物质,写出Cl2溶于水发生反应的离子方程式________________。
(2)C1O2是一种高效、低毒的消毒剂,逐渐取代Cl2成为生产自来水的消毒剂。KClO3与SO2在强酸性溶液中反应可制得C1O2,此反应的离子方程式为_________________。ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为___________。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、ClO2氧化性更强,无二次污染的绿色水处理剂。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。由以上信息可知,相同条件下,高铁酸钠溶解度比高铁酸钾溶解度______ (填“大”或“小”)。干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应每生成1 molNa2FeO4转移____mol电子。
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是_______。该图示的总反应为 ______。
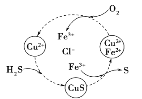
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型绿色消毒剂,其在消毒(发生氧化还原反应)后可形成Fe(OH)3胶体,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
(1)干法制备高铁酸钾时,先制备得到Na2FeO4,反应如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中,氧化剂是________,氧化产物是________。
②每生成1 mol Na2FeO4,转移________mol电子。
(2)配平湿法制备高铁酸钾反应的离子方程式:
______Fe(OH)3+______ClO-+______OH-===______FeO42-+______Cl-+______H2O
(3)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,该反应表明氧化性:K2FeO4______(填“>”或“<”)Cl2。
(4)Fe(OH)3胶体可使水中悬浮物沉降下来,用作净水剂。
①实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是_____________________。
②下列有关胶体的说法不正确的是________(填字母代号)。
a.光束通过Fe(OH)3胶体时形成光亮的“通路”
b.往Fe(OH)3胶体中加入稀硫酸,先出现红褐色沉淀,后沉淀溶解消失
c.Fe(OH)3胶体粒子不能透过滤纸,能透过半透膜
d.Fe(OH)3胶体发生电泳时,其胶体粒子向阴极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8g H218O含有的中子数为NA
B. 0.1mol·L-1 MgCl2溶液中含有的Mg2+数目一定小于0.1NA
C. 0.1mol 的CH4和NH3混合气体,含有的共价键数目为0.4NA
D. 4.6g Na与含0.1mol HCl的稀盐酸充分反应,转移电子数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com