
【题目】已知:在25 oC 101KPa时
①1g氢气完全燃烧生成气态水放出120.9 KJ的热量
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
③Na2O2(s)+CO2(g)=Na2CO3(s)+![]() ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
在相同条件下根据以上信息回答下列问题:
(1)请书写氢气完全燃烧生成气态水的热化学方程式_______________________________。
(2)CO的燃烧热为ΔH=_____。
(3)请写出Na2O2(s)与CO(g)反应生成Na2CO3(s)的热化学方程式_______________________。
(4)请计算CO(g)与Na2O2(s)反应放出1018kJ热量时,转移电子的物质的量__________________。
【答案】2H2(g) + O2(g) == 2H2O(g) △H = -483.6KJ·mol- -283 kJ/mol Na2O2(s) + CO(g) = Na2CO3(s) ΔH=-509 kJ/mol 4 mol
【解析】
(1)根据“1g氢气完全燃烧生成气态水放出120.9KJ的热量”计算出2mol氢气完全燃烧放出的热量,根据热化学方程式的书写方法写出热化学方程式;
(2)燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量,据此计算出一氧化碳的燃烧热;
(3)根据盖斯定律及题中热化学方程式写出Na2O2(s)与CO(g)反应生成Na2CO3(s)的热化学方程式;
(4)根据放出的热量计算出消耗一氧化碳的物质的量,然后根据化合价变化计算出转移的电子数。
(1)1g氢气完全燃烧生成气态水放出120.9kJ的热量,4g氢气完全燃烧生成气态水放出的热量为:483.6kJ,氢气完全燃烧生成气态水的热化学方程式为:2H2(g) + O2(g) == 2H2O(g) △H = -483.6KJ·mol-1,故答案为:2H2(g) + O2(g) == 2H2O(g) △H = -483.6KJ·mol-1;
(2)1 molCO完全燃烧生成稳定氧化物二氧化碳时所放出的热量为:![]() ×566kJ=283kJ,△H= -283kJ/mol,故答案为:-283kJ/mol;
×566kJ=283kJ,△H= -283kJ/mol,故答案为:-283kJ/mol;
(3)②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;③Na2O2(s)+CO2(g)=Na2CO3(s)+![]() ΔH=-226 kJ/mol;根据盖斯定律,③+②÷2可得:Na2O2(s) + CO(g) = Na2CO3(s) ΔH=-509 kJ/mol,故答案为:Na2O2(s) + CO(g) = Na2CO3(s) ΔH=-509 kJ/mol;
ΔH=-226 kJ/mol;根据盖斯定律,③+②÷2可得:Na2O2(s) + CO(g) = Na2CO3(s) ΔH=-509 kJ/mol,故答案为:Na2O2(s) + CO(g) = Na2CO3(s) ΔH=-509 kJ/mol;
(4)CO(g)与Na2O2(s)反应放出1018kJ热量,消耗一氧化碳的物质的量为:![]() =2mol,CO转化成二氧化碳,化合价升高2价,所以反应消耗2mol一氧化碳失去了2mol×2=4mol电子,故答案为:4mol。
=2mol,CO转化成二氧化碳,化合价升高2价,所以反应消耗2mol一氧化碳失去了2mol×2=4mol电子,故答案为:4mol。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】Ge、Na及其化合物在航空航天、电子工业上有重要应用。请回答下列问题:
(1)基态Ge原子价层电子的排布式为___,其电子填充的最高能级的轨道数为___。电子占据最高能级的电子云轮廓图为___形。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是___。
(3)硼氢化钠(NaBH4)是有机化学中的一种常用还原剂,[BH4]-的空间构型是__,中心原子的杂化形式为___。NaBH4中存在___(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)NaC1是离子晶体,其晶格能可通过下图的循环计算得到。
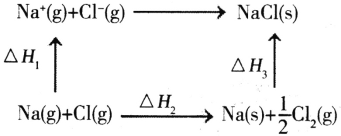
△H(晶格能)=___。
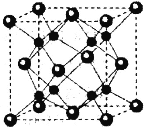
(5)Na2O的立方晶胞如图所示,氧离子采取面心立方堆积,钠离子填在由氧离子形成的__空隙中。已知晶胞边长a=0.566nm,晶胞中O原子的配位数为__;该晶体的密度是___g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaClO2的实验流程如图所示,反应I中发生的反应为3NaClO3+4SO2+3H2O====2ClO2+Na2SO4+3H2SO4+NaCl,下列说法中正确的是

A. 反应Ⅱ中H2O2做还原剂
B. 产品中含有SO42-、Cl-
C. NaClO2的漂白原理与SO2相同
D. 实验室进行结晶操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将N2、H2混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后各物质反应速率为甲υ(H2)=3 mol·L-1·min-1;乙υ(N2)=2 mol·L-1·min-1;丙υ(NH3)=1 mol·L-1·min-1。在这段时间内三个容器中合成氨的反应速率( )
A. 甲>乙>丙 B. 甲=乙=丙 C. 乙>甲>丙 D. 甲>丙>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )
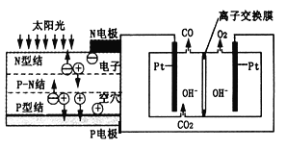
A. 由图分析N电极为电池的正极
B. 阴极的电极反应为CO2+H2O+2e-=CO+2OH-
C. OH-通过离子交换膜迁向左室
D. 反应完毕,该装置中电解质溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10mol·L的氨水滴定l0.00mL0.05mol·L-1H2A溶液,加入氨水的体积(V)与溶液中lg![]() 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
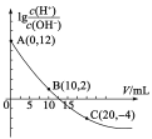
A.A点溶液的pH等于1
B.由图中数据可知,H2A为弱酸
C.B点水电离出的H+离子浓度为1.0×10-6mol·L-1
D.C点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物VL (标准状况),溶于mg水中,得到质量分数为w、 物质的量浓度为c mol/L、密度为g/mL的溶液,下列说法正确的是( )
A.相对分子质量 M=22.4mω/(1-ω)V
B.物质的量浓度c=ρv/(MV+22.4m)
C.溶液的质量分数ω=MV/22.4m
D.溶液密度ρ=cω/1000ρω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com