
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
【答案】蒸馏 过滤 N2+3H2![]() 2NH3 CaSO4+CO2+2NH3+H2O===CaCO3↓+2NH4++SO42- 用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3(或其他可行的方法) CaO CO2
2NH3 CaSO4+CO2+2NH3+H2O===CaCO3↓+2NH4++SO42- 用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3(或其他可行的方法) CaO CO2
【解析】
煤和水蒸气反应生成氢气和一氧化碳,利用空气中氮气和氢气在高温高压催化剂作用下反应生成氨气,煤燃烧生成的二氧化碳和生成的氨气和硫酸钙一起进入沉淀池中发生反应,生成碳酸钙沉淀和产品硫酸铵,碳酸钙煅烧得到副产品氧化钙,生成的二氧化碳进入沉淀池循环使用。
(1)合成氨原料之一氮气来源于空气,分离方法是将空气液化后蒸发分离出O2获得N2,所以操作①为液化;将沉淀池中的混合物经过滤可得到产品和沉淀,则操作②为过滤。因此,本题正确答案是:液化;过滤;
(2)工业上利用氮气和氢气在高温高压催化剂的条件下合成氨气,此反应的化学方程式为: N2+3H2![]() 2NH3 ,因此,本题正确答案是:N2+3H2
2NH3 ,因此,本题正确答案是:N2+3H2![]() 2NH3 。
2NH3 。
(3)产品是(NH4)2SO4,反应物是CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3, CaSO4悬浊液在离子方程中要写分子式,反应化学方程式为: CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,改写成离子方程式为: CaSO4+CO2+2NH3+H2O=CaCO3↓+2NH4++SO42-;
因此,本题正确答案是: CaSO4+CO2+2NH3+H2O=CaCO3↓+2NH4++SO42- ;
(4) 检验NH3的方法是:用湿润的红色石蕊试纸放在管口处,若试纸变蓝,证明废气中有NH3存在;因此,本题正确答案是:用湿润的红色石蕊试纸放在管口处,若试纸变蓝,证明废气中有NH3;
(5) 因为CaCO3煅烧可生成CO2和CaO,其中CO2可循环使用,所以CaO为副产品,因此,本题正确答案是:CaO;CO2。


科目:高中化学 来源: 题型:
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。
)是一种常见的有机合成中间体,在生产中用途广泛。
有机物A为原料合成M和N的路线如下所示:

已知:I.R-CH=CH2+HBr ![]() R-CH2CH2Br
R-CH2CH2Br
II.R-CH2-CN![]() R-CH2-COOH
R-CH2-COOH ![]()
![]()
请回答下列问题:
(1)A分子中共面的原子数最多为___________个,-CN的电子式为___________。
(2)②的反应类型为___________,E分子中所含官能团的名称为___________,G的结构简式为______________________。
(3)写出反应⑤的化学方程式__________________________。
(4)写出M在酸性条件下水解的化学方程式______________________。
(5)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有___________种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:___________。
(6)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。
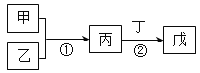
(1)若甲由短周期中原子半径最大的金属元素组成,请写出丙中18电子双原子阴离子的电子式___。
(2)若乙、丁混合或丙、丁混合均产生白烟,则戊所含的化学键有___。
(3)若甲、丙均既能与盐酸反应又能与氢氧化钠溶液反应,则戊的水溶液在空气中加热直至灼烧最后得到的固体物质为___。
(4)若丙是一种有刺激性气味的气体,常温下0.1mol/L戊溶液的pH=0.7,请写出反应②的离子方程式___。
(5)若反应①是常见的可逆反应、放热反应,该反应的适宜条件是:铁触媒做催化剂,温度700K左右,压强30-50Mpa。戊是一种酸式盐。请写出戊的阴离子电离方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ |
阴离子 | NO3- CO32- Cl- SO42- |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀硝酸 | 放出标准状况下0.56L无色气体 |
Ⅱ | 向Ⅰ的反应混合液中加入过量的硝酸钡,产生白色沉淀,对沉淀洗涤、干燥,称量所得固体质量 | 固体质量为9.32克 |
Ⅲ | 向Ⅱ的滤液中滴加硝酸银溶液 | 无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是___。
(2)实验Ⅰ中生成气体的离子方程式为___。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。___
阴离子 | NO3- | CO32- | Cl- | SO42- |
c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①16gCuSO4·5H2O溶于1L水所得溶液的物质的量浓度为0.1mol/L
②标准状况下,11.2L H2和14g N2所含原子数相同
③1 mol的Cl﹣含有NA个电子
④1mol粒子集合体所含的粒子数与0.012kg C中所含的碳原子相同
⑤同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③B.②⑤⑥C.②④⑤⑥D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习和研究化学,经常要进行实验,完成下列与实验相关的试题。
(1)实验室制备气体时,若实验装置出现下图所示情况时,不漏气的是__________ 。
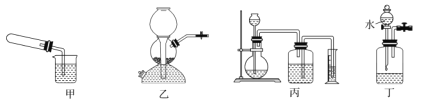
A.装置甲用手握试管一段时间,再松开手
B.装置乙放入CaCO3和稀盐酸,并关闭出气口活塞
C.装置丙烧瓶内放入金属Zn和稀硫酸
D.装置丁广口瓶中装有MnO2和H2O2,关闭出气口止水夹,打开分液漏斗活塞
(2)欲用萃取分液的方法在碘水中提取碘,一般可选用________为萃取剂,分液漏斗使用前须________并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并________后,将分液漏斗置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先_____________,然后打开活塞放出下层液体,上层液体从上口倒出。
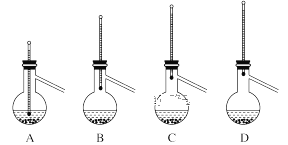
(3)分液后蒸馏提纯时,需要用到的玻璃仪器除了酒精灯、蒸馏烧瓶、温度计、牛角管、锥形瓶外,还有___________;蒸馏烧瓶加热时需加垫石棉网,瓶中液体需加沸石,若已开始加热,发现忘记加沸石,应进行的操作是__________________;下列装置中温度计位置正确的是_____________,可能会导致收集到的产品中混有低沸点杂质的装置是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组同学设计如图实验装置(部分夹持仪器未画出)探究氨气的还原性并检验部分产物。
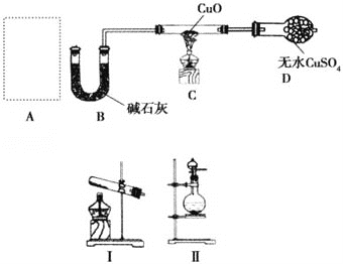
(1)若A中使用装置Ⅰ制取氨气,则化学方程式为__,发生装置试管口略向下倾斜的原因_____;若A中使用装置Ⅱ制取氨气,则分液漏斗中的试剂为__,圆底烧瓶中的固体可以为__。
(2)B中碱石灰的作用是__。
(3)氨气还原炽热氧化铜的化学方程式为__,装置C中的实验现象为__,装置D中的实验现象为__。
(4)①该装置存在明显的缺陷是__。
②请画出改进后需要增加连接的实验装置图________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.
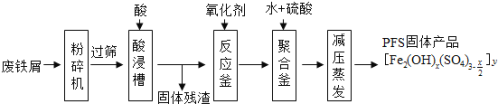
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_______。粉碎过筛的目的是________。
(2)酸浸时最合适的酸是______,写出铁锈与酸反应的离子方程式_________。
(3)反应釜中加入氧化剂,下列氧化剂中最合适的是______(填标号).
A.KMnO4 B.Cl2C.H2O2D.HNO3
(4)相对于常压蒸发,减压蒸发的优点是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com