
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。
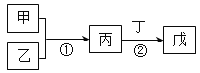
(1)若甲由短周期中原子半径最大的金属元素组成,请写出丙中18电子双原子阴离子的电子式___。
(2)若乙、丁混合或丙、丁混合均产生白烟,则戊所含的化学键有___。
(3)若甲、丙均既能与盐酸反应又能与氢氧化钠溶液反应,则戊的水溶液在空气中加热直至灼烧最后得到的固体物质为___。
(4)若丙是一种有刺激性气味的气体,常温下0.1mol/L戊溶液的pH=0.7,请写出反应②的离子方程式___。
(5)若反应①是常见的可逆反应、放热反应,该反应的适宜条件是:铁触媒做催化剂,温度700K左右,压强30-50Mpa。戊是一种酸式盐。请写出戊的阴离子电离方程式___。
【答案】![]() 离子键和共价键 Al2O3或Al2(SO4)3或NaAlO2 SO2+H2O2=2H++SO42- HSO4-=H++SO42-或HSO3-
离子键和共价键 Al2O3或Al2(SO4)3或NaAlO2 SO2+H2O2=2H++SO42- HSO4-=H++SO42-或HSO3-![]() H++SO32-
H++SO32-
【解析】
(1)甲为短周期中原子半径最大的元素,则为钠;丙中阴离子核外有18个电子,则单质乙中元素的质子数应小于9,从而确定其为O,丙中阴离子为O22-。
(2)白烟通常为盐,最常见的是NH4Cl,生成它的气体要么为Cl2、NH3,要么为HCl、NH3;
(3)若甲、丙均既能与盐酸反应又能与氢氧化钠溶液反应,则甲为Al,丙为Al2O3,丁能溶解Al2O3,则其为酸,可能为盐酸、硝酸或硫酸,也可能为强碱,由此可得出戊的组成。
(4)常温下0.1mol/L戊溶液的pH=0.7,则其为二元强酸,即为硫酸,所以丙为SO2,丁为H2O2。
(5)若反应①是常见的可逆反应、放热反应,该反应的适宜条件是:铁触媒做催化剂,温度700K左右,压强30-50Mpa,则为工业合成氨的反应,戊是一种酸式盐,则丁为二元酸,可能为硫酸,可能为亚硫酸,从而得出戊可能为硫酸氢盐,可能为亚硫酸氢盐。
(1)由前面分析可知,甲为钠,则乙为O2,丙为Na2O2,其阴离子为O22-,电子式为
![]() ;答案为
;答案为![]() 。
。
(2)若乙、丁混合或丙、丁混合均产生白烟,由于乙为单质,则丁为NH3,丙为HCl,乙为Cl2,甲为H2,戊为NH4Cl,则戊所含的化学键有离子键和共价键;答案:离子键和共价键。
(3)若甲、丙均既能与盐酸反应又能与氢氧化钠溶液反应,则甲为Al,丙为Al2O3,乙为O2,丁能溶解Al2O3,则其为酸,可能为盐酸、硝酸或硫酸,也可能为NaOH,从而得出戊可能为AlCl3、Al(NO3)3、Al2(SO4)3、NaAlO2。若戊为AlCl3、Al(NO3)3,存在反应AlCl3+3H2O![]() Al(OH)3+3HCl↑,Al(NO3)3+3H2O
Al(OH)3+3HCl↑,Al(NO3)3+3H2O![]() Al(OH)3+3HNO3↑,2Al(OH)3
Al(OH)3+3HNO3↑,2Al(OH)3![]() Al2O3+3H2O,则最终所得固体为Al2O3;若戊为Al2(SO4)3,则最终所得固体为Al2(SO4)3;若戊为NaAlO2,则最终所得固体为NaAlO2。答案:Al2O3或Al2(SO4)3或NaAlO2。
Al2O3+3H2O,则最终所得固体为Al2O3;若戊为Al2(SO4)3,则最终所得固体为Al2(SO4)3;若戊为NaAlO2,则最终所得固体为NaAlO2。答案:Al2O3或Al2(SO4)3或NaAlO2。
(4)常温下0.1mol/L戊溶液的pH=0.7,则其为二元强酸,即为硫酸,所以丙为SO2,丁为H2O2,反应②的离子方程式SO2+H2O2=2H++SO42-。答案:SO2+H2O2=2H++SO42-。
(5)反应①是工业合成氨的反应,戊是一种酸式盐,则丁为二元酸,可能为硫酸,可能为亚硫酸,从而得出戊可能为硫酸氢铵,可能为亚硫酸氢铵。戊的阴离子电离方程式HSO4-=H++SO42-或HSO3-![]() H++SO32-。答案:HSO4-=H++SO42-或HSO3-
H++SO32-。答案:HSO4-=H++SO42-或HSO3-![]() H++SO32-。
H++SO32-。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】钛酸钡被誉为“电子陶瓷工业的支柱”。工业制取方法如图,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)24H2O],煅烧后可获得钛酸钡粉体。
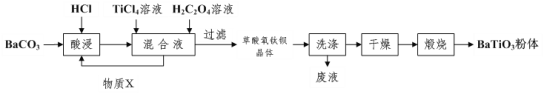
(1)酸浸时发生的反应的离子方程式为___。
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是___。
(3)加入H2C2O4溶液时,发生反应的化学方程式为___。可循环使用的物质X是___(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:___。
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气态产物有CO、___。
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.59×10-9,请问至少需要___molL-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
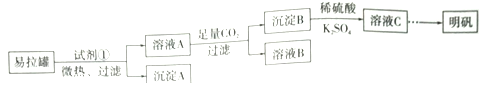
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
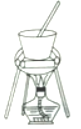
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不正确的是
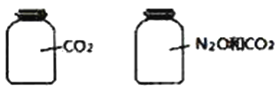
A. 所含氧原子数相等 B. 气体的总质量相等
C. 气体所含电子总数相等 D. 气体的密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解100mLHNO3 与AgNO3 的混合液,通电一段时间后,两极均收集到4.48L气体(标准状况),则原混合液中Ag+的物质的量浓度为( )
A. 1mol·L-1B. 2mol·L-1C. 2.5mol·L-1D. 4mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com