
【题目】侯氏制碱法制备的工业产物主要是( )
A. 碳酸钠B. NaOHC. 碳酸氢钠D. 氯化铵
【答案】A
【解析】
“侯氏制碱法”的基本原理是:在浓氨水中通入足量的二氧化碳生成一种盐,然后在此盐溶液中加入细的食盐粉末.原始原料有浓氨水、二氧化碳、氯化钠,先制得NaHCO3,进而生产出纯碱,副产品氯化铵,据此分析解答。
A. “侯氏制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+H2O+CO2↑,所以工业产物主要是Na2CO3,故A正确;
Na2CO3+H2O+CO2↑,所以工业产物主要是Na2CO3,故A正确;
B.“侯氏制碱法”无论反应物、生成物、中间产物,均与氢氧化钠无关,故B错误;
C.由A可以知道NaHCO3为中间产物,故C错误;
D.氯化铵为副产品,故D错误;
故答案选A。


科目:高中化学 来源: 题型:
【题目】2018年11月13日第26届国际计量大会对国际单位制进行修改。新的摩尔的定义规定,1摩尔物质包括阿伏加德罗常数NA个基本单元。下列有关阿伏加德罗常数NA的说法正确的是( )
A.常温常压下,11gCO2中含有0.75NA个原子
B.2.4g镁变成镁离子时,失去的电子数目为0.1NA
C.标准状况下,NA个水分子的体积约为22.4L
D.1L 0.3mol/L的NaCl溶液中含有0.3NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32+、Cu2+、Ba2+和Na+,探究小组为了确定该溶液中离子的组成,取该溶液100mL进行实验。
步骤 | 实验操作及现象 | 实验结论 | 判断理由 |
I | 加入过量NaOH溶液,生成蓝色沉淀 | 肯定有Cu2+,肯定无____ | 肯定无该离子的理由:_____________ |
II | 将生成的蓝色沉淀过滤、洗涤,灼烧得到24.0g黑色固体。 | Cu2+的物质的量浓度为__ | Cu元素守恒 |
III | 向Ⅱ所得滤液中加入足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的白色沉淀。 | 肯定有Cl-和__肯定无Ba2+ | 肯定有Cl-的理由:______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、( NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,现象和有关数据如图所示(气体体积数据换算成标准状况)。关于该固体混合物,下列说法正确的是( )
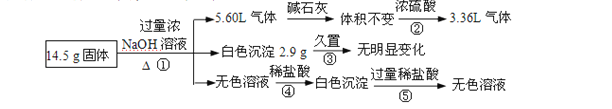
A.含有4.5gAl
B.不含FeCl2、AlCl3
C.含有物质的量相等的( NH4)2SO4和MgCl2
D.含有MgCl2、FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。
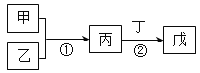
(1)若甲由短周期中原子半径最大的金属元素组成,请写出丙中18电子双原子阴离子的电子式___。
(2)若乙、丁混合或丙、丁混合均产生白烟,则戊所含的化学键有___。
(3)若甲、丙均既能与盐酸反应又能与氢氧化钠溶液反应,则戊的水溶液在空气中加热直至灼烧最后得到的固体物质为___。
(4)若丙是一种有刺激性气味的气体,常温下0.1mol/L戊溶液的pH=0.7,请写出反应②的离子方程式___。
(5)若反应①是常见的可逆反应、放热反应,该反应的适宜条件是:铁触媒做催化剂,温度700K左右,压强30-50Mpa。戊是一种酸式盐。请写出戊的阴离子电离方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属冶炼产生的废弃物中,常含有砷元素(与磷同主族),由于有毒需检测与处理。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
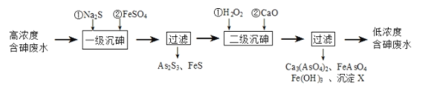
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为___;砷酸的第一步电离方程式为__。
(2)“一级沉砷”中FeSO4的作用是___。
(3)“二级沉砷”中H2O2与含砷物质反应的化学方程式为___。沉淀X为___(填化学式)。
Ⅱ.强阴离子交换柱可以吸附以阴离子形态存在的As(V)达到去除As的目的。采用该方法去除水体中的砷时,可选用NaClO将As(Ⅲ)转化为As(V)。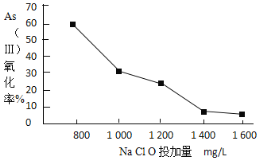
已知:一定条件下,As(V)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO4 | HAsO42 | HAsO42、AsO43 |
(4)pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是___。
Ⅲ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成(即未能检出)。
(5)请写出步骤2的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①16gCuSO4·5H2O溶于1L水所得溶液的物质的量浓度为0.1mol/L
②标准状况下,11.2L H2和14g N2所含原子数相同
③1 mol的Cl﹣含有NA个电子
④1mol粒子集合体所含的粒子数与0.012kg C中所含的碳原子相同
⑤同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③B.②⑤⑥C.②④⑤⑥D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
![]()
![]() ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com