
����Ŀ����Na��Ũ��Ϊ0.5mol��L��1��ij������Һ�У������ܺ����±��е����������ӡ�
������ | K�� Ag�� Mg2�� Ba2�� |
������ | NO3- CO32- Cl- SO42- |
��ȡ����Һ100mL��������ʵ��(����������ڱ�״���²ⶨ)��
��� | ʵ������ | ʵ���� |
�� | �����Һ�м�������ϡ���� | �ų���״����0.56L��ɫ���� |
�� | ���ķ�Ӧ���Һ�м�����������ᱵ��������ɫ�������Գ���ϴ�ӡ�����������ù������� | ��������Ϊ9.32�� |
�� | ������Һ�еμ���������Һ | ���������� |
��ش��������⡣
��1��ʵ�����ȷ��һ�������ڵ�������___��
��2��ʵ�����������������ӷ���ʽΪ___��
��3��ͨ��ʵ���ͱ�Ҫ���㣬��д�±��������ӵ�Ũ��(�ܼ�����ģ���д��������һ�������ڵ���������0��������ȷ���Ƿ���ڵ����������)��___
������ | NO3- | CO32- | Cl- | SO42- |
c/mol��L��1 |
��4���ж�K���Ƿ���ڣ�������������СŨ�ȣ���������˵�����ɣ�___��
���𰸡�Ag����Mg2����Ba2�� CO32-��2H��=CO2����H2O
������ | NO3- | CO32- | Cl- | SO42- |
c/mol��L��1 | �� | 0.25 | 0 | 0.4 |
���ڣ���СŨ��Ϊ0.8mol��L��1
��������
����������ҺΪ������Һ����֪����Һ�к��е�����һ���ܹ��������棻��ʵ����֪���μ�����ϡ����ų���״����0.56L��ɫ���壬�����Һ��һ������CO32-����Ũ��Ϊ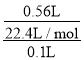 =0.25mol/L����һ��û��Ag+��Mg2+��Ba2+�����ķ�Ӧ���Һ�м�����������ᱵ��������ɫ�������Գ���ϴ�ӡ�����������ù�������Ϊ9.32�ˣ��˳���ΪBaSO4�����ʵ���Ϊ
=0.25mol/L����һ��û��Ag+��Mg2+��Ba2+�����ķ�Ӧ���Һ�м�����������ᱵ��������ɫ�������Գ���ϴ�ӡ�����������ù�������Ϊ9.32�ˣ��˳���ΪBaSO4�����ʵ���Ϊ![]() =0.4mol��������Һ�еμ���������Һ������������˵����Һ����Cl-���ٽ�ϵ���غ�������ɡ�
=0.4mol��������Һ�еμ���������Һ������������˵����Һ����Cl-���ٽ�ϵ���غ�������ɡ�
��ʵ����֪���μ�����ϡ����ų���״����0.56L��ɫ���壬�����Һ��һ������CO32-����Ũ��Ϊ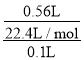 =0.25mol/L����һ��û��Ag+��Mg2+��Ba2+�����ķ�Ӧ���Һ�м�����������ᱵ��������ɫ�������Գ���ϴ�ӡ�����������ù�������Ϊ9.32�ˣ��˳���ΪBaSO4�����ʵ���Ϊ
=0.25mol/L����һ��û��Ag+��Mg2+��Ba2+�����ķ�Ӧ���Һ�м�����������ᱵ��������ɫ�������Գ���ϴ�ӡ�����������ù�������Ϊ9.32�ˣ��˳���ΪBaSO4�����ʵ���Ϊ![]() =0.04mol��������Һ�еμ���������Һ������������˵����Һ����Cl-��
=0.04mol��������Һ�еμ���������Һ������������˵����Һ����Cl-��
(1)�ɷ���֪��ʵ�����ȷ��һ�������ڵ�������Ag+��Mg2+��Ba2+��
(2)ʵ����е���ϡ�������ɵ�����ΪCO2��������Ӧ�����ӷ���ʽΪCO32-��2H��=CO2����H2O��
(3)�з���֪����Һ��һ�����е���������CO32-��SO42-��һ��������Cl-�����ж��Ƿ����NO3-���Ҹ���ԭ���غ��֪��CO32-��Ũ��Ϊ0.25mol/L��SO42-��Ũ��Ϊ![]() =0.4mol/L��
=0.4mol/L��
(4)�������ϼ����֪������ȷ��NO3-��c(CO32-)=0.25mol/L��c(SO42-)=0.4mol/L��һ��������Cl-������c(Cl-)=0�����ݵ���غ�2c(CO32-+)+2c(SO42-)=2��0.25mol/L+2��0.4mol/L=1.3mol/L��0.5mol/L�������Һ��һ������K+������Ũ������Ϊ0.8mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ��ˮ�ۺ����ò������̣��й�˵������ȷ����
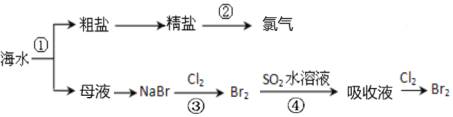
A.���������������漰�����ϡ��ֽ⡢���ֽ���û���Ӧ
B.��ֻ���������仯
C.���ǹ�ҵ�ϵ�ⱥ��ʳ��ˮ�Ʊ�Cl2
D.�ۢ��漰�ķ�Ӧ��Ϊ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������[KAl(SO4)2��12H2O]��һ���Σ�����ֽ�ȷ���Ӧ�ù㷺��ij��ȤС�����10.0g��������(��90%��Al��������������Fe��Mg�����ʣ��Ʊ�������ʵ�鷽�����£�
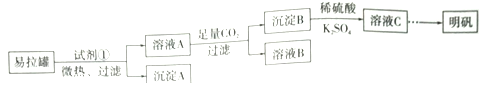
��1���Լ���Ӧѡ��_____________(����ţ���
a.���� b.H2SO4��Һ c.�Ȼ�����Һ d.NaOH��Һ
��2���������ܽ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ____________________��
��3����ҺB�����ʵ���Ҫ�ɷ�Ϊ____________________ (�ѧʽ)��
��4������ҺC�еõ�������ʵ���������Ϊ����Ũ����__________(��������ƣ������ˡ�ϴ�ӡ��������ͼ��ʾ�����������е�һ��������_____________��
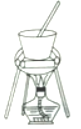
��5����С����ʵ�����֮�õ�118.5 g�������������Ļ�����Ϊ_____________������֪��������Ħ������Ϊ474g��mol-1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ������SiO2 ��̼��Ӧ����ȡ�裬д����Ӧ�Ļ�ѧ����ʽ___________________��
��ҵ�ϻ���������þ��ȡ�裬��ӦΪ2Mg+SiO2 = 2MgO+Si��ͬʱ�ᷢ������Ӧ��2Mg + Si = Mg2Si����ͼ�ǽ���Mg��SiO2��Ӧ��ʵ��װ�ã��Իش��������⣺

��1������O2��H2O��g���Ĵ��ڶԸ�ʵ���нϴ�Ӱ�죬ʵ����Ӧͨ������X��Ϊ���������Թ��еĹ���ҩƷ��ѡ��________(�����)��
a��ʯ��ʯ������b��п��������c������
��2��ʵ�鿪ʼʱ��������ͨһ��ʱ��X���壬�ټ��ȷ�Ӧ��������� ___________________________������Ӧ���������߾ƾ��ƣ���Ӧ�ܼ������У���ԭ����______________________��
��3����Ӧ��������ȴ������ʱ������Ӧ��Ļ�����м���ϡ���ᣬ�ɹ۲쵽�����Ļ��ǣ������������ԭ���Ǹ�����Mg2Si������Ѹ�ٷ�Ӧ����SiH4�����飩���壬Ȼ��SiH4��ȼ���û�ѧ����ʽ��ʾ��������Ӧ��________________________��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ƿ�����ȵ����壬��ͬ��ͬѹʱƿ�����壨N2O��CO2��������ѧ��Ӧ���Ĺ�ϵ����ȷ����
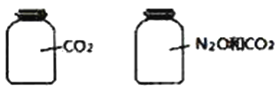
A. ������ԭ������� B. ��������������
C. ������������������� D. ������ܶ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������100mL1.0 mol/L Na2SO4��Һ����ȷ�ķ�����( )
�ٽ�14.2 g Na2SO4������100mLˮ��
�ڽ�32.2g Na2SO410H2O��������ˮ�У�����ˮϡ����100 mL
�۽�20 mL 5.0 mol/L Na2SO4��Һ��ˮϡ����100 mL
A.�٢�B.�ڢ�C.�٢�D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼������ʱ�У�Ҳ�ǻ���Ҫ������̼���ڹ�ҵ�����������ش������ԭ���ϣ����ŷŻ�����ŷ�������������ͬ����������������ȶ��Ǻܺõ�����̼��������ʽ�������Ǽ����������÷�����������Һ������������������淋Ĺ��գ�

��ش��������⣺
��1�����ղ����������ֱ�Ϊ____________��____________��
��2����ҵ�ϳɰ��Ļ�ѧ����ʽΪ��__________��
��3��д����������Ʒ�������ӷ���ʽ��________��
��4����ʵ�����м���ϳɰ����ų��ķ������Ƿ��а����ķ�����______________��
��5������Ʒ�Ļ�ѧʽΪ________________�����������������п���ѭ��ʹ�õ�������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ����˵����ȷ���ǣ�������
A.�����£���ӦNH3��g��+HCl��g����NH4Cl��s�����Է�������Ӧ����÷�Ӧ����H��0
B.�״�ȼ�ϵ�ع���ʱ���״��õ����ӣ�������ԭ��Ӧ
C.�����£�0.1molL��1CH3COOH��Һ��ˮϡ�ͺ���Һ��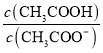 ��ֵ��С
��ֵ��С
D.��Na2CO3��Һ�м�������Ca��OH��2���壬CO32��ˮ��̶ȼ�С����Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������480 mL 0.1 mol��L��1������ͭ��Һ����ѡȡ500 mL����ƿ�������ƣ����²��������Ƴɹ����ǣ� ��
A.��ȡ7.68 g CuSO4��ĩ������500 mLˮ
B.��ȡ12.5 g CuSO4��5H2O���壬��ˮ���500 mL��Һ
C.��ȡ8.0 g CuSO4��ĩ������500 mLˮ
D.��ȡ8.0 g CuSO4��5H2O���壬��ˮ���500 mL��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com