
����Ŀ��ѧϰ���о���ѧ������Ҫ����ʵ�飬���������ʵ����ص����⡣
(1)ʵ�����Ʊ�����ʱ����ʵ��װ�ó�����ͼ��ʾ���ʱ����©������__________ ��
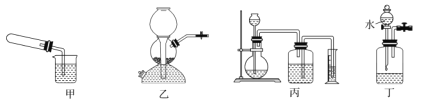
A.װ�ü��������Թ�һ��ʱ�䣬���ɿ���
B.װ���ҷ���CaCO3��ϡ���ᣬ���رճ����ڻ���
C.װ�ñ���ƿ�ڷ������Zn��ϡ����
D.װ�ö����ƿ��װ��MnO2��H2O2���رճ�����ֹˮ�У���Һ©������
(2)������ȡ��Һ�ķ����ڵ�ˮ����ȡ�⣬һ���ѡ��________Ϊ��ȡ������Һ©��ʹ��ǰ��________��ϴ�����á���ȡʱ���Ⱥ�������ȡҺ����ȡ��������ҡ��________����Һ©����������̨����Ȧ�Ͼ���Ƭ�̣��ֲ㡣�������²�Һ��ʱ��Ӧ��_____________��Ȼ������ų��²�Һ�壬�ϲ�Һ����Ͽڵ�����
(3)��Һ�������ᴿʱ����Ҫ�õ��IJ����������˾ƾ��ơ�������ƿ���¶ȼơ�ţ�ǹܡ���ƿ�⣬����___________��������ƿ����ʱ��ӵ�ʯ������ƿ��Һ����ӷ�ʯ�����ѿ�ʼ���ȣ��������Ǽӷ�ʯ��Ӧ���еIJ�����__________________������װ�����¶ȼ�λ����ȷ����_____________�����ܻᵼ���ռ����IJ�Ʒ�л��еͷе����ʵ�װ����________��
���𰸡�C �������Ȼ�̼ ��© ���� ���Ͽڲ�����(��ʹ���ϵİ��۶�©�����ϵ�С��) ֱ�������ܻ������� ��ȴ�� C AB
��������
(1)A.�������Թ�һ��ʱ�䣬�Թ����������ȣ�
B.װ���ҷ���CaCO3��ϡ���ᣬ���رճ����ڻ�����������Ͽ��ݳ���
C.װ�ñ���ƿ�ڷ������Zn��ϡ���ᣬ��������������ˮ�ŵ���Ͳ�У�
D.װ�ö����ƿ��װ��MnO2��H2O2���رճ�����ֹˮ�У���Һ©��������ˮ����˳�����£�
(2)ʹ�õ��л��ܼ�Ҫ��ˮ�������ܣ��Ҵ���ˮ���ܣ���������ȡ������Һ©����©ˮ��ʹ�ã���ҡ�ȡ�������������̨�Ͼ���Ƭ�̣��ֲ㣬����ƽ����ѹ�ٽ��з�Һ������
(3)������Ҫ������������֣��������Ǽӷ�ʯ��Ӧ��ȴ�����º��ټӣ��¶ȼƲⶨ��ֵ��¶ȣ�Ӧ����ƿ��֧�ܿڴ���λ��ƫ��ʱ���еͷе����ʡ�
(1)A.�������Թ�һ��ʱ�䣬�Թ����������ȣ�ͼ�������ݣ�˵��©����A���������⣻
B.װ���ҷ���CaCO3��ϡ���ᣬ���رճ����ڻ�����������Ͽ��ݳ������ܼ��������ԣ���B���������⣻
C.װ�ñ���ƿ�ڷ������Zn��ϡ���ᣬ��������������ˮ�ŵ���Ͳ�У���֪װ�ò�©����C�������⣻
D.װ�ö����ƿ��װ��MnO2��H2O2���رճ�����ֹˮ�У���Һ©��������ˮ����˳�����£���ͼ��ˮ�����£�װ��©����D���������⣻
�ʺ���ѡ����C��
(2)������ȡ��Һ�ķ����ڵ�ˮ����ȡ�⣬һ���ѡ�ñ������Ȼ�̼Ϊ��ȡ�����ò����в������Ҵ���ȡ��ԭ�����Ҵ���ˮ���ܡ���Һ©��ʹ��ǰ���©��ϴ�����á���ȡʱ���Ⱥ�������ȡҺ����ȡ��������ҡ����������Һ©����������̨����Ȧ�Ͼ���Ƭ�̣��ֲ㡣�������²�Һ��ʱ��Ӧ�ȴ��Ͽڲ�����(��ʹ���ϵİ��۶�©�����ϵ�С��)��Ȼ������ų��²�Һ�壬Ȼ���ϲ�Һ����Ͽڵ�����
(3)��Һ�������ᴿʱ����Ҫ�õ��IJ����������˾ƾ��ơ�������ƿ���¶ȼơ�ţ�ǹܡ���ƿ�⣬���������ܣ�������ƿ����ʱ��ӵ�ʯ������ƿ��Һ����ӷ�ʯ�����ѿ�ʼ���ȣ��������Ǽӷ�ʯ��Ӧ������ȴ�Ӳ�����װ�����¶ȼ�λ����ȷ����C�����ܻᵼ���ռ����IJ�Ʒ�л��еͷе����ʵ�װ���¶ȼ�λ��ƫ��ʱ��װ�ã�����ѡ����AB��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ƿ�����ȵ����壬��ͬ��ͬѹʱƿ�����壨N2O��CO2��������ѧ��Ӧ���Ĺ�ϵ����ȷ����
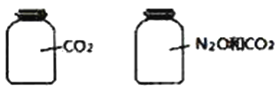
A. ������ԭ������� B. ��������������
C. ������������������� D. ������ܶ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼������ʱ�У�Ҳ�ǻ���Ҫ������̼���ڹ�ҵ�����������ش������ԭ���ϣ����ŷŻ�����ŷ�������������ͬ����������������ȶ��Ǻܺõ�����̼��������ʽ�������Ǽ����������÷�����������Һ������������������淋Ĺ��գ�

��ش��������⣺
��1�����ղ����������ֱ�Ϊ____________��____________��
��2����ҵ�ϳɰ��Ļ�ѧ����ʽΪ��__________��
��3��д����������Ʒ�������ӷ���ʽ��________��
��4����ʵ�����м���ϳɰ����ų��ķ������Ƿ��а����ķ�����______________��
��5������Ʒ�Ļ�ѧʽΪ________________�����������������п���ѭ��ʹ�õ�������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п������õİ�ͷ����������H�ĺϳ�·����ͼ��ʾ��

��֪����RCH2Br![]() R-HC=CH-R��
R-HC=CH-R��
��R-HC=CH-R��![]()
��R-HC=CH-R��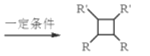
(1)A���ڷ���������������________________��
(2)B�Ľṹ��ʽ��______________________��
(3)��C����D�Ļ�ѧ����ʽ��__________________��
(4)��![]() ��Ϊͬ���칹���ҷ��������������л�����_________�֣����������칹����
��Ϊͬ���칹���ҷ��������������л�����_________�֣����������칹����
�ٱ�����ֻ������ȡ����
����![]() ������ͬ�Ĺ�����
������ͬ�Ĺ�����
�����������µ�ˮ�������ʹFeCl3��Һ����ɫ��
д�����к˴Ź�������Ϊ�����Ľṹ��ʽ��_________��дһ�ּ��ɣ�
(5)�Լ�b��_______________��
(6)����˵����ȷ����________(����ĸ���)��
a��G����˳���칹��
b����G����H�ķ�Ӧ�Ǽӳɷ�Ӧ
c��1 mol G��������1 mol H2�����ӳɷ�Ӧ
d��1 mol F��1 mol H������NaOH��Һ��Ӧ��������2 mol NaOH
(7)����ϩΪ��ʼԭ�ϣ������֪��Ϣѡ�ñ�Ҫ�����Լ��ϳ�![]() ��д���ϳ�·��(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����):_____��
��д���ϳ�·��(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����):_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ����˵����ȷ���ǣ�������
A.�����£���ӦNH3��g��+HCl��g����NH4Cl��s�����Է�������Ӧ����÷�Ӧ����H��0
B.�״�ȼ�ϵ�ع���ʱ���״��õ����ӣ�������ԭ��Ӧ
C.�����£�0.1molL��1CH3COOH��Һ��ˮϡ�ͺ���Һ��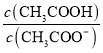 ��ֵ��С
��ֵ��С
D.��Na2CO3��Һ�м�������Ca��OH��2���壬CO32��ˮ��̶ȼ�С����Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϣ���500��600 �����м��ͨ������������ˮ�Ȼ�����������ͼ��ʾ��װ��ģ���������̽���ʵ�顣
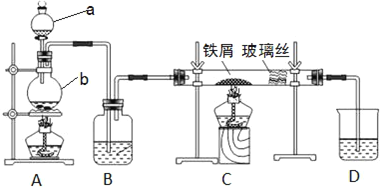
��1��д�����������ƣ�a_______��b________��
��2��A�з�Ӧ�Ļ�ѧ����ʽΪ________��C�з�Ӧ�Ļ�ѧ����ʽΪ________��
��3��װ��B�м�����Լ���________��
��4����֪��������м��ͨ���Ȼ����������������ˮ�Ȼ�������Ϊ��ֹ������FeCl2���ɣ�����װ��__��__������ĸ��������һ��ʢ��________��ϴ��ƿ��
��5��װ��D��������________��Ϊ��ֹˮ����Ӱ����ˮ�Ȼ�������ȡ���������һ����װ��D�ĸĽ�������________��
��6����Ӧ������ȡ����װ��C�еĹ������Թ��У������������ᣬ������ȫ�ܽ⣬�õ���ҺX��֤����ҺX�к���FeCl3���Լ���________���۲쵽��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ò��缫���100mLHNO3 ��AgNO3 �Ļ��Һ��ͨ��һ��ʱ����������ռ���4.48L���壨��״��������ԭ���Һ��Ag+�����ʵ���Ũ��Ϊ�� ��
A. 1mol��L��1B. 2mol��L��1C. 2.5mol��L��1D. 4mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͬ���ʵ������ơ�þ�������������ᷴӦʱ�ų������������Ϊ__________����ͬ�������ơ�þ�������������ᷴӦʱ�ų��������������_________���ֱ�Ϊ0.3 mol���ơ�þ����Ͷ��100 mL 1 mol��L-1��������Һ�У����߲������������______________��
��2����һ�������Ƶ��������ڳ���CO2���壬Ȼ��������ע��������NaOH��Һ�������ý����ܷ�ڡ�����һ��ʱ��ޱ��ڰ������ٹ�һ��ʱ����˵Ĺޱ����¹�������
�ޱ��ڰ������ԭ����______________________�����ӷ���ʽ����Ϊ____________________________��
���ٹ����ԭ����___________________________�����ӷ���ʽ����Ϊ___________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com