
����Ŀ����ҵ�ϣ���500��600 �����м��ͨ������������ˮ�Ȼ�����������ͼ��ʾ��װ��ģ���������̽���ʵ�顣
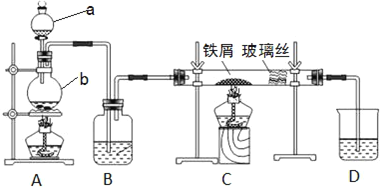
��1��д�����������ƣ�a_______��b________��
��2��A�з�Ӧ�Ļ�ѧ����ʽΪ________��C�з�Ӧ�Ļ�ѧ����ʽΪ________��
��3��װ��B�м�����Լ���________��
��4����֪��������м��ͨ���Ȼ����������������ˮ�Ȼ�������Ϊ��ֹ������FeCl2���ɣ�����װ��__��__������ĸ��������һ��ʢ��________��ϴ��ƿ��
��5��װ��D��������________��Ϊ��ֹˮ����Ӱ����ˮ�Ȼ�������ȡ���������һ����װ��D�ĸĽ�������________��
��6����Ӧ������ȡ����װ��C�еĹ������Թ��У������������ᣬ������ȫ�ܽ⣬�õ���ҺX��֤����ҺX�к���FeCl3���Լ���________���۲쵽��������________��
���𰸡� ��Һ©�� Բ����ƿ 4HCl��Ũ��+MnO2![]() MnCl2+Cl2��+2H2O 2Fe+3Cl2
MnCl2+Cl2��+2H2O 2Fe+3Cl2![]() 2FeCl3 Ũ���� A B ����ʳ��ˮ ��ȥ������������ֹ����Ⱦ���� ��Ϊһ��ʢ�м�ʯ�ҵĸ���ܣ�����װ��C��D֮������һ��ʢ��Ũ�����ϴ��ƿ�� ���軯����Һ������Һ�� ��Һ��Ϊ��ɫ������Һ��Ϊ��ɫ��
2FeCl3 Ũ���� A B ����ʳ��ˮ ��ȥ������������ֹ����Ⱦ���� ��Ϊһ��ʢ�м�ʯ�ҵĸ���ܣ�����װ��C��D֮������һ��ʢ��Ũ�����ϴ��ƿ�� ���軯����Һ������Һ�� ��Һ��Ϊ��ɫ������Һ��Ϊ��ɫ��
��������
װ��A���Ʊ������ķ���װ�ã����ɵ������к��Ȼ����ˮ������ͨ��װ��B��Ũ�������������ͨ��װ��C��Ӧ������ˮ�Ȼ�����ʣ������ͨ������������Һ���գ��ݴ��жϡ�
��1���������Ĺ����֪aΪ��Һ©����bΪԲ����ƿ��
��2��Aװ����ȡ����������ʵ���ҳ���Ũ������������̼�����ȡ����ѧ��Ӧ����ʽΪ4HCl��Ũ��+MnO2![]() MnCl2+Cl2��+2H2O��CΪ���������Ʊ��Ȼ�������Ӧ����ʽΪ2Fe+3Cl2
MnCl2+Cl2��+2H2O��CΪ���������Ʊ��Ȼ�������Ӧ����ʽΪ2Fe+3Cl2![]() 2FeCl3��
2FeCl3��
��3��Ϊ�Ʊ���ˮ�Ȼ�����Bװ��ӦΪʢ��Ũ����ĸ���������װ�ã���װ��B�м�����Լ���Ũ���
��4���Ʊ��������л����Ȼ������壬�������ڸ���֮ǰ���Ȼ��⣬����A��B�����ӱ���ʳ��ˮ��װ�ã�
��5�������ж�������Ⱦ������Dװ�����������Ƴ�δ��Ӧ�����������ֹ����Ⱦ������Ϊ�Ʊ���ˮ�Ȼ�������ֹD��ˮ��������Cװ�ã���ѡ�ü�ʯ�ҵĸ���ܣ���������������������ˮ������װ��C��D֮������һ��ʢ��Ũ�����ϴ��ƿ��
��6�����������������軯�ػ��߱��ӣ����������ӣ����軯����Һ���ɫ��������Һ����ɫ��


 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���Cl-��SO42-��CO32+��Cu2+��Ba2+��Na+,̽��С��Ϊ��ȷ������Һ�����ӵ���ɣ�ȡ����Һ100mL����ʵ�顣
���� | ʵ����������� | ʵ����� | �ж����� |
I | �������NaOH��Һ��������ɫ���� | �϶���Cu2+,�϶���____ | �϶������ӵ����ɣ�_____________ |
II | �����ɵ���ɫ�������ˡ�ϴ��,���յõ�24.0g��ɫ���塣 | Cu2+�����ʵ���Ũ��Ϊ__ | CuԪ���غ� |
III | ���������Һ�м�������Ba(NO3)2��Һ���õ�46.6g������ϡ����İ�ɫ������ | �϶���Cl-��__�϶���Ba2+ | �϶���Cl-�����ɣ�______________ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
��16gCuSO4��5H2O����1Lˮ������Һ�����ʵ���Ũ��Ϊ0.1mol/L
�ڱ�״���£�11.2L H2��14g N2����ԭ������ͬ
��1 mol��Cl������NA������
��1mol���Ӽ�������������������0.012kg C��������̼ԭ����ͬ
��ͬ��ͬ���ʱ���������ʵ����ʵ���Խ����ѹǿԽ��
��ͬ��ͬѹ�£�������ܶ����������Է�������������
A.�٢ڢ�B.�ڢݢ�C.�ڢܢݢ�D.�٢ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѧϰ���о���ѧ������Ҫ����ʵ�飬���������ʵ����ص����⡣
(1)ʵ�����Ʊ�����ʱ����ʵ��װ�ó�����ͼ��ʾ���ʱ����©������__________ ��
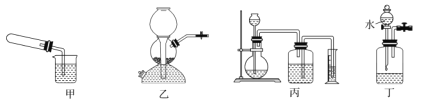
A.װ�ü��������Թ�һ��ʱ�䣬���ɿ���
B.װ���ҷ���CaCO3��ϡ���ᣬ���رճ����ڻ���
C.װ�ñ���ƿ�ڷ������Zn��ϡ����
D.װ�ö����ƿ��װ��MnO2��H2O2���رճ�����ֹˮ�У���Һ©������
(2)������ȡ��Һ�ķ����ڵ�ˮ����ȡ�⣬һ���ѡ��________Ϊ��ȡ������Һ©��ʹ��ǰ��________��ϴ�����á���ȡʱ���Ⱥ�������ȡҺ����ȡ��������ҡ��________����Һ©����������̨����Ȧ�Ͼ���Ƭ�̣��ֲ㡣�������²�Һ��ʱ��Ӧ��_____________��Ȼ������ų��²�Һ�壬�ϲ�Һ����Ͽڵ�����
(3)��Һ�������ᴿʱ����Ҫ�õ��IJ����������˾ƾ��ơ�������ƿ���¶ȼơ�ţ�ǹܡ���ƿ�⣬����___________��������ƿ����ʱ��ӵ�ʯ������ƿ��Һ����ӷ�ʯ�����ѿ�ʼ���ȣ��������Ǽӷ�ʯ��Ӧ���еIJ�����__________________������װ�����¶ȼ�λ����ȷ����_____________�����ܻᵼ���ռ����IJ�Ʒ�л��еͷе����ʵ�װ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Y�����ڸ����ܹ�ѧ��֬�ĺϳɣ����ɻ�����X��2������ϩ������һ�������·�Ӧ�Ƶã�
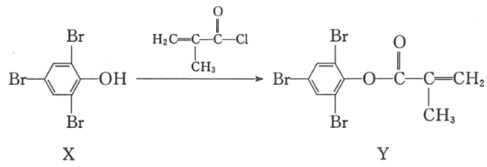
�����й�X��Y��˵����ȷ���ǣ�������
A.X����������ԭ��һ����ͬһƽ����
B.Y��Br2�ļӳɲ�������к�������̼ԭ��
C.X��Y������ʹ���Ը��������Һ��ɫ
D.������FeCl3��Һ����X��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ͬѧ�����ͼʵ��װ�ã����ּг�����δ������̽�������Ļ�ԭ�Բ����鲿�ֲ��
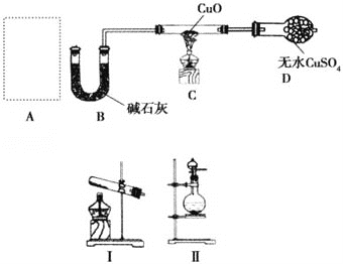
��1����A��ʹ��װ�â���ȡ��������ѧ����ʽΪ__������װ���Թܿ���������б��ԭ��_____����A��ʹ��װ�â���ȡ���������Һ©���е��Լ�Ϊ__��Բ����ƿ�еĹ������Ϊ__��
��2��B�м�ʯ�ҵ�������__��
��3��������ԭ��������ͭ�Ļ�ѧ����ʽΪ__��װ��C�е�ʵ������Ϊ__��װ��D�е�ʵ������Ϊ__��
��4���ٸ�װ�ô������Ե�ȱ����__��
���뻭���Ľ�����Ҫ�������ӵ�ʵ��װ��ͼ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijЩ�л���֮����ת�����Դ���̫���ܣ���ԭ����Ƭ��ϩ(NBD)����̫������ת����Ϊ�Ļ���(Q)����֪�� ��C7H8(l)(NBD)��9O2(g)=7CO2(g)��4H2O(l)����H1����C7H8(l)(Q)��9O2(g)=7CO2(g)��4H2O(l)����H2����
![]()
![]() ����H��+88.62 kJ��mol��1��������������ȷ����(����)
����H��+88.62 kJ��mol��1��������������ȷ����(����)
A. ��H1>��H2 B. NBD��������Q��������
C. NBD��Q�ȶ� D. NBDת��ΪQ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ����Ǹ��л�ѧ���õ�������������������йؼ��㡣
(1)��0.3 mol Al3����Al2(SO4)3��������SO42�������ʵ�����___________��
(2)___________g H2O2����ԭ������0.2 mo lH3PO4����ԭ������ȡ�
(3)������ͬ��H2��NH3��SO2��O3���������У�����ԭ����Ŀ���ٵ���_____(��д��ѧʽ)��
(4)����涨��1mol���Ӽ�������������������0.024 kg 12C��������̼ԭ������ͬ����ô��36.5 g HCl����ˮ�������Һ500mL������Һ��Ũ��Ϊ_________mol/L��
(5)ͬ��ͬѹ�£�ij��������������116g��������������̼��122g���ֳ���ij������114g����������Ħ������Ϊ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ�������й�˵����ȷ����( )
A.38g3H2O2�к���3NA���ۼ�
B.��״���£�2.24L F2ͨ����������ʳ��ˮ�п��û���0.1NA��Cl2
C.�����£���5.6g����Ͷ������Ũ�����У�ת��0.3NA����
D.1L 0.5mol��L1 pH=7��CH3COONH4��Һ��NH4+��ĿΪ0.5NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com