
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.
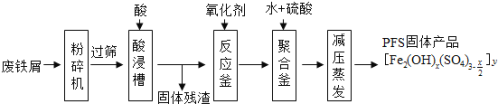
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_______。粉碎过筛的目的是________。
(2)酸浸时最合适的酸是______,写出铁锈与酸反应的离子方程式_________。
(3)反应釜中加入氧化剂,下列氧化剂中最合适的是______(填标号).
A.KMnO4 B.Cl2C.H2O2D.HNO3
(4)相对于常压蒸发,减压蒸发的优点是____________。
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解100mLHNO3 与AgNO3 的混合液,通电一段时间后,两极均收集到4.48L气体(标准状况),则原混合液中Ag+的物质的量浓度为( )
A. 1mol·L-1B. 2mol·L-1C. 2.5mol·L-1D. 4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需用480 mL 0.1 mol·L-1的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作能配制成功的是( )
A.称取7.68 g CuSO4粉末,加入500 mL水
B.称取12.5 g CuSO4·5H2O晶体,加水配成500 mL溶液
C.称取8.0 g CuSO4粉末,加入500 mL水
D.称取8.0 g CuSO4·5H2O晶体,加水配成500 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。回答有关中和反应的问题:
(1)用0.1molNaOH配成稀溶液与足量稀硝酸反应,放出_____热量。
(2)如图装置中缺少的一种玻璃仪器是___,碎泡沫塑料的作用____。
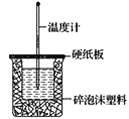
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ·mol-1,其原因可能是____。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热ΔH会___(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:
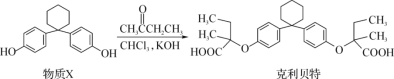
下列有关叙述正确的是
A. 物质X分子中所有碳原子不可能位于同一平面内
B. 1mol物质X最多可以与含2 mol Br2的溴水反应
C. 克利贝特分子中含有三个手性碳原子
D. 用饱和NaHCO3溶液可以鉴别物质X和克利贝特
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的钠、镁、铝与足量盐酸反应时放出氢气的体积比为__________。相同质量的钠、镁、铝与足量盐酸反应时放出氢气的体积比是_________。分别为0.3 mol的钠、镁、铝投入100 mL 1 mol·L-1的硫酸溶液中,三者产生的体积比是______________。
(2)在一个用铝制的易拉罐内充满CO2气体,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口。经过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起来。
罐壁内凹而瘪的原因是______________________,离子方程式可能为____________________________;
罐再鼓起的原因是___________________________,离子方程式可能为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。

(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3-+4H++3e-═NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质(甲)能使上述还原过程发生。则下列说法中正确的是( )
A.物质甲可能是KMnO4
B.反应中只体现了硝酸的强氧化性
C.氧化过程的反应式一定为Cu2O-2e-+2H+═2Cu2++H2O
D.反应中若产生3.0 g气体,则转移电子数约为0.3×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com