
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。回答有关中和反应的问题:
(1)用0.1molNaOH配成稀溶液与足量稀硝酸反应,放出_____热量。
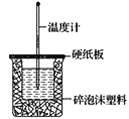
(2)如图装置中缺少的一种玻璃仪器是___,碎泡沫塑料的作用____。
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ·mol-1,其原因可能是____。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热ΔH会___(填“偏大”、“偏小”或“无影响”)。
【答案】5.73kJ 环形玻璃搅拌棒 保温、隔热的作用 实验过程中难免有热量散失 偏大
【解析】
(1)根据H+(aq)+OH-(aq)═H2O(l) △H=-57.3kJmol-1可知生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量;
(2)中和热测定的实验中需要量筒、温度计、环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作;
(3)若保温效果不好,有热量散失,求得的中和热ΔH将会偏大;
(4)根据弱电解质电离吸热分析。
(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJmol-1可知生成1molH2O放出热量为57.3kJ,而0.1mol NaOH配成稀溶液与足量稀硝酸反应可得0.1molH2O,所以放出的热量为57.3kJ×0.1=5.73kJ;
(2)中和热测定的实验中需要量筒、温度计、环形玻璃搅拌棒,还缺少环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热作用;
(3)若保温效果不好,有热量散失,求得的中和热ΔH将会偏大,△H大于-57.3kJmol-1;
(4)NH3H2O为弱碱,电离过程为吸热过程,用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热ΔH的数值偏大,则中和热ΔH会偏大。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①16gCuSO4·5H2O溶于1L水所得溶液的物质的量浓度为0.1mol/L
②标准状况下,11.2L H2和14g N2所含原子数相同
③1 mol的Cl﹣含有NA个电子
④1mol粒子集合体所含的粒子数与0.012kg C中所含的碳原子相同
⑤同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③B.②⑤⑥C.②④⑤⑥D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
![]()
![]() ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.3 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________g H2O2所含原子数与0.2 mo lH3PO4所含原子数相等。
(3)质量相同的H2、NH3、SO2、O3四种气体中,含有原子数目最少的是_____(填写化学式)。
(4)如果规定,1mol粒子集合体所含的粒子数与0.024 kg 12C中所含的碳原子数相同。那么将36.5 g HCl溶于水中配成溶液500mL,则溶液的浓度为_________mol/L。
(5)同温同压下,某容器充满氧气重116g,若充满二氧化碳重122g,现充满某气体重114g,则该气体的摩尔质量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
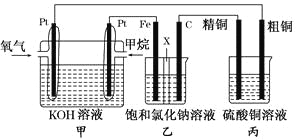
(1)甲烷燃料电池负极反应式为________________________。
(2)石墨(C)极的电极反应式为_______________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体的体积为________L;丙装置中阴极析出铜的质量为________ g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
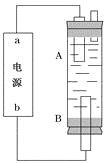
若用于制漂白液,a为电池的________极,电解质溶液最好用)________________
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用________作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.
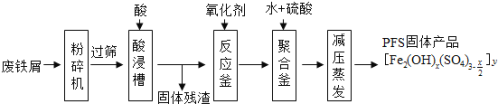
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_______。粉碎过筛的目的是________。
(2)酸浸时最合适的酸是______,写出铁锈与酸反应的离子方程式_________。
(3)反应釜中加入氧化剂,下列氧化剂中最合适的是______(填标号).
A.KMnO4 B.Cl2C.H2O2D.HNO3
(4)相对于常压蒸发,减压蒸发的优点是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Ⅰ是有机合成中间体,如可合成J或高聚物等,其合成J的线路图如图:
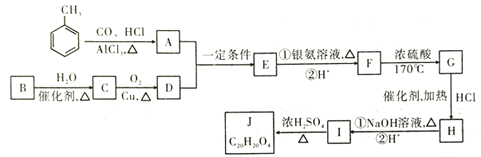
已知:①![]() ,A苯环上的一氯代物只有2种
,A苯环上的一氯代物只有2种
②有机物B是最简单的单烯烃,J为含有3个六元环的酯类
③![]()
![]() (
(![]() 、
、![]() 为烃基或H原子)
为烃基或H原子)
回答以下问题:
(1)A的化学名称为_____;E的化学式为_____。
(2)![]() 的反应类型:____;H分子中官能团的名称是____。
的反应类型:____;H分子中官能团的名称是____。
(3)J的结构简式为____。
(4)写出I在一定条件下生成高聚物的化学反应方程式____。
(5)有机物K是G的一种同系物,相对分子质量比G少14,则符合下列条件的K的同分异构体有___种(不考虑立体异构)。
a.苯环上只有两个取代基
b.既能发生银镜反应也能与![]() 溶液反应
溶液反应
写出其中核磁共振氢谱有6个峰,峰面积之比为2:2:1:1:1:1的结构简式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列有关说法正确的是( )
A.38g3H2O2中含有3NA共价键
B.标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C.常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D.1L 0.5mol·L1 pH=7的CH3COONH4溶液中NH4+数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.天宫二号空间实验室己于2016年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是___________(填化学式),该物质的类别属于_______(填“碱性氧化物”或“酸性氧化物”),实验室中不能用玻璃塞的试剂瓶盛放KOH溶液,原因是___________________(用离子方程式表示)。
(2)太阳能电池帆板是“天宫二号”空间运行的动力。其性能直接影响到“天宫二号”的运行寿命和可靠性。天宫二号使用的光太阳能电池,该电池的核心材料是_______,其能量转化方式为____________________。
II.铝和氢氧化钾都是重要的工业产品。
请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是____________________。
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____________(填序号)。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,若能,则不用填写理由,若不能,理由是(用离子方程式说明)___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com