
【题目】I.天宫二号空间实验室己于2016年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是___________(填化学式),该物质的类别属于_______(填“碱性氧化物”或“酸性氧化物”),实验室中不能用玻璃塞的试剂瓶盛放KOH溶液,原因是___________________(用离子方程式表示)。
(2)太阳能电池帆板是“天宫二号”空间运行的动力。其性能直接影响到“天宫二号”的运行寿命和可靠性。天宫二号使用的光太阳能电池,该电池的核心材料是_______,其能量转化方式为____________________。
II.铝和氢氧化钾都是重要的工业产品。
请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是____________________。
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____________(填序号)。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,若能,则不用填写理由,若不能,理由是(用离子方程式说明)___________________。
【答案】SiO2 酸性氧化物 SiO2+2OH- =SiO32-+H2O Si(或晶体硅) 太阳能转化为电能 2Al+2OH-+2H2O=2AlO![]() +3H2↑ bd 不能 Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+
+3H2↑ bd 不能 Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+
【解析】
I.(1)石英玻璃的成分为二氧化硅,二氧化硅能和碱反应生成盐和水;玻璃中含二氧化硅,和碱反应生成的硅酸钠溶液能使瓶塞和瓶口粘结在一起;
(2)天宫二号使用的光伏太阳能电池的核心材料是半导体硅,太阳能电池是将太阳能转化为电能;
II.(1)Al和KOH溶液反应生成偏铝酸钾和氢气;
(2)铝热反应需要引发剂引发反应,结合铝热反应的实验分析判断;铁能和铁离子反应生成亚铁离子,亚铁离子和KSCN溶液不反应,据此分析解答。
I.(1)石英玻璃的成分为二氧化硅,化学式为SiO2,二氧化硅和碱反应生成盐和水,属于酸性氧化物;玻璃中含二氧化硅,和碱反应生成的硅酸钠溶液,是一种矿物胶,瓶塞和瓶口会粘结在一起,不易打开,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2;酸性氧化物;SiO2+2OH-=SiO32-+H2O;
(2)天宫二号使用的光伏太阳能电池的核心材料是半导体硅,天宫二号使用的光伏太阳能电池是将太阳能转化为电能,故答案为:Si;太阳能转化为电能;
II.(1)Al和KOH溶液反应生成偏铝酸钾和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)铝热反应需要引发剂产生高温,引发反应,镁条在空气中可以燃烧,氧气是氧化剂。插入混合物中的部分镁条燃烧时,氯酸钾是氧化剂,以保证镁条的继续燃烧,同时放出足够的热量引发氧化铁和铝粉的反应,所以还需要的试剂是氯酸钾和Mg,故选bd;
铁能和铁离子反应生成亚铁离子,亚铁离子和KSCN溶液无明显现象,所以根据该现象不能确定固态中是否含有氧化铁,涉及的离子方程式分别为Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,故答案为:bd;不能;Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。回答有关中和反应的问题:
(1)用0.1molNaOH配成稀溶液与足量稀硝酸反应,放出_____热量。
(2)如图装置中缺少的一种玻璃仪器是___,碎泡沫塑料的作用____。
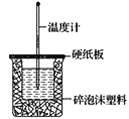
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ·mol-1,其原因可能是____。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热ΔH会___(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
A.NaH与H2O反应生成氢气,每生成0.6g氢气转移电子数为0.6NA
B.12g镁在空气中充分燃烧,电子转移数目为NA
C.0.1 mol熔融NaHSO4中含有阳离子数目为0.1NA
D.标准状况下,6.72 L O2和N2的混合气体含有的原子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠,镁,铝,铁四种金属组成的混合物6 g,与足量的稀硫酸反应,产生标准状况下的氢气6.72 L,由此判断混合物中必含 ( )
A.钠B.镁C.铝D.铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3-+4H++3e-═NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质(甲)能使上述还原过程发生。则下列说法中正确的是( )
A.物质甲可能是KMnO4
B.反应中只体现了硝酸的强氧化性
C.氧化过程的反应式一定为Cu2O-2e-+2H+═2Cu2++H2O
D.反应中若产生3.0 g气体,则转移电子数约为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种最新合成的溶瘤药物,可通过以下方法合成:
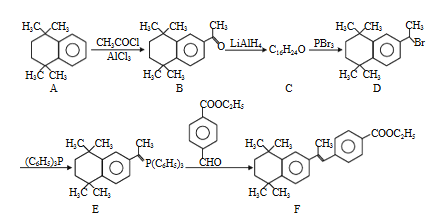
⑴D中所含官能团名称为________。
⑵A→B的反应类型是________。
⑶B的分子式为________。
⑷C的结构简式为________。
⑸A的核磁共振氢谱有_______种类型氢原子的吸收峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。请帮他们完成实验报告。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A,请填空。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是______(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为_____ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到________(填现象) |
(2)综合上述实验现象和结论___(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_____________,此实验______(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点______(填“正确”或“错误”),原因是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
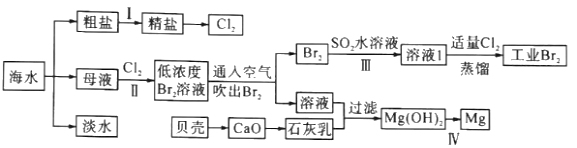
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:__。
(2)海水提溴,制得1molBr2需要消耗__molCl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是___。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为___。
(3)判断Mg(OH)2是否洗涤干净的操作是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com