
【题目】用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
A.NaH与H2O反应生成氢气,每生成0.6g氢气转移电子数为0.6NA
B.12g镁在空气中充分燃烧,电子转移数目为NA
C.0.1 mol熔融NaHSO4中含有阳离子数目为0.1NA
D.标准状况下,6.72 L O2和N2的混合气体含有的原子数目为0.6NA
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是
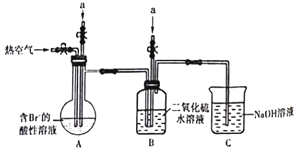
A.装置中通入的是a气体是Cl2
B.实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气
C.B装置中通入a气体前发生的反应为SO2+ Br2+2H2O===H2SO4+2HBr
D.C装置的作用只是吸收多余的二氧化硫气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
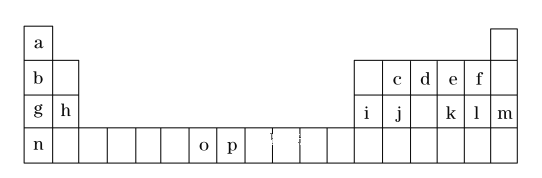
试回答下列问题:
①表中碱性最强的为_______(写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
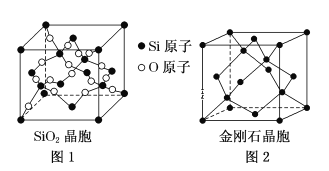
①推测SiO2晶胞中Si采用______杂化,O—Si—O的键角为___________。
②一个SiO2晶胞中,含有_______个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏伽德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】翡翠是玉石中的一种,其主要成分为硅酸铝钠NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。请回答下列问题:
(1)基态镍原子的外围电子排布图为___________;与其同周期的基态原子的M层电子全充满的元素位于周期表的__________、___________区。
(2)翡翠中主要成分硅酸铝钠中四种元素电负性由小到大的顺序是___________。
(3)铬可以形成CrCl3·x NH3(x=3、4、5、6)等一系列配位数为6的配合物。
①NH3分子的ⅤSEPR模型是___________。
②键角大小关系NH3___________PH3(填“>”<”或“=”)。
③NF3不易与Cr3+形成配离子,其原因是___________。
(4)铁有δ、γ、α三种同素异形体,如下图所示。
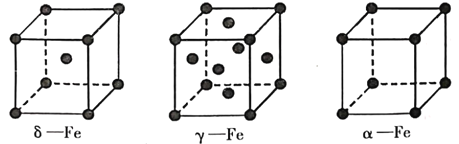
γ-Fe晶体的一个晶胞中所含有的铁原子数为___________,δ-Fe、α-Fe两种晶胞中铁原子的配位数之比为___________。已知δ-Fe晶体的密度为dg/cm,NA表示阿伏伽德罗常数的数值,则Fe原子半径为___________pm(列表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从矿物学资料查得,一定条件下FeS2(二硫化亚铁)存在反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2参加反应,有10 mol电子转移
C.FeS2只作还原剂
D.产物中的![]() 有一部分是氧化产物
有一部分是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】翡翠是玉石中的一种,其主要成分为硅酸铝钠NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。请回答下列问题:
(1)基态镍原子的外围电子排布图为___________;与其同周期的基态原子的M层电子全充满的元素位于周期表的__________、___________区。
(2)翡翠中主要成分硅酸铝钠中四种元素电负性由小到大的顺序是___________。
(3)铬可以形成CrCl3·x NH3(x=3、4、5、6)等一系列配位数为6的配合物。
①NH3分子的ⅤSEPR模型是___________。
②键角大小关系NH3___________PH3(填“>”<”或“=”)。
③NF3不易与Cr3+形成配离子,其原因是___________。
(4)铁有δ、γ、α三种同素异形体,如下图所示。
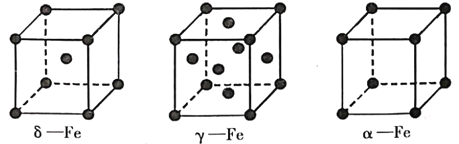
γ-Fe晶体的一个晶胞中所含有的铁原子数为___________,δ-Fe、α-Fe两种晶胞中铁原子的配位数之比为___________。已知δ-Fe晶体的密度为dg/cm,NA表示阿伏伽德罗常数的数值,则Fe原子半径为___________pm(列表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构简式可以用“键线式”表示,其中线表示键,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来。已知利用某些有机物之间的转化可贮存太阳能,如降冰片二烯(NBD)经太阳光照射转化成四环烷(Q)的反应为 (反应吸热),下列叙述中错误的是( )
(反应吸热),下列叙述中错误的是( )
A. NBD和Q互为同分异构体
B. Q可使溴水褪色
C. Q的一氯代物只有3种
D. NBD的同分异构体可以是芳香烃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com