
【题目】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
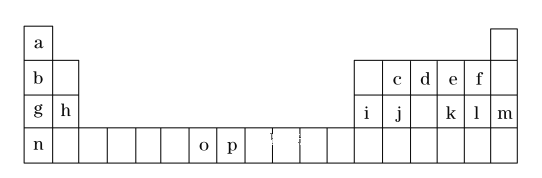
试回答下列问题:
①表中碱性最强的为_______(写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
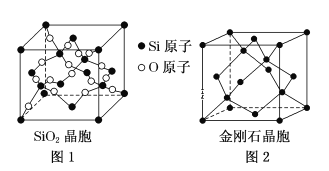
①推测SiO2晶胞中Si采用______杂化,O—Si—O的键角为___________。
②一个SiO2晶胞中,含有_______个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏伽德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。
【答案】KOH HF ![]() 配位键 Si>Mg>Al>Na sp3 109°28′ 8 大于
配位键 Si>Mg>Al>Na sp3 109°28′ 8 大于 ![]()
【解析】
(一)根据元素在周期表中的位置知,a到p分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素;结合原子结构与性质分析解答;
(二)①SiO2晶胞中Si原子形成4个Si-O键,没有孤电子对,杂化轨道数目为4,形成S-O正四面体结构,据此分析解答;
②SiO2晶胞中,4个Si处于晶胞内部,另外原子处于晶胞顶点、面心,根据均摊法计算晶胞中Si原子数目;
③金刚石和晶体硅都是原子晶体,碳原子半径小于硅原子半径,则C-C共价键的键能大于Si-Si共价键的键能,据此分析判断;
④根据均摊法,计算一个金刚石晶胞中含有碳原子数,进而计算晶胞的质量和晶胞的体积,最后计算晶胞的密度。
(一)根据元素在周期表中的位置知,a到p分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素;
①元素的金属性越强,最高价氧化物的水化物的碱性越强,碱性最强的是KOH;元素的非金属性越强,氢化物越稳定,稳定性最强的为HF,故答案为:KOH;HF;
②基态Mn原子的外围电子为其3d、4s电子,其外围电子排布图为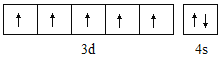 ,Fe3+离子与KSCN反应新生成的化学键为配位键,故答案为:
,Fe3+离子与KSCN反应新生成的化学键为配位键,故答案为: ;配位键;
;配位键;
③同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能Si>Mg>Al>Na,故答案为:Si>Mg>Al>Na;
(二)①SiO2晶胞中Si原子形成4个Si-O键,没有孤电子对,杂化轨道数目为4,Si原子采取sp3杂化,形成S-O正四面体结构,O-Si-O的键角为:109°28′,故答案为:sp3;109°28′;
②SiO2晶胞中,4个Si处于晶胞内部,另外原子处于晶胞顶点、面心,晶胞中Si原子数目=4+8×![]() +6×
+6×![]() =8,由化学式可知晶胞中O原子数目=8×2=16,故答案为:8;
=8,由化学式可知晶胞中O原子数目=8×2=16,故答案为:8;
③金刚石和晶体硅都是原子晶体,具有相似的结构,由于碳原子半径小于硅原子半径,则C-C共价键的键能大于Si-Si共价键的键能,因此熔点:金刚石>Si晶体,故答案为:大于;
④根据图示,一个金刚石晶胞中含有碳原子数=4+8×![]() 6×
6×![]() =8,则晶胞的质量=
=8,则晶胞的质量=![]() g,晶胞的体积为pm3=(a ×10-10)cm3,因此晶胞的密度=
g,晶胞的体积为pm3=(a ×10-10)cm3,因此晶胞的密度= =
=![]() g·cm-3,故答案为:
g·cm-3,故答案为:![]() 。
。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
(4)利用氧化还原滴定方法,在70~80 ℃条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1 h的目的是_____。
(2)如何保证在70~80 ℃ 条件下进行滴定操作:_____。
(3)准确量取一定体积的KMnO4溶液用_____(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用____(填序号)。
A.H2C2O4·2H2O B.FeSO4
C.浓盐酸 D.Na2SO3
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL:
①滴定终点标志是___;
②所配制KMnO4标准溶液的物质的量浓度为__ mol·L-1;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将___(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写:
(1) 我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按照一定比例混合而成的,爆炸时的化学反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。该反应中氧化剂是_____,还原剂是______,_____元素被氧化,每生成6.72LCO2(标准状况下)气体需要__g硫参加反应,并用双线桥法来表示电子转移的方向和数目:______。
(2)铁是人类较早使用的金属之一。
①鉴别![]() 胶体和
胶体和![]() 溶液的常用方法是_____,两者本质区别是_____ 。
溶液的常用方法是_____,两者本质区别是_____ 。
②电子工业中用![]() 溶液腐蚀敷在绝缘板上的铜生产氯化亚铁和氯化铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜生产氯化亚铁和氯化铜,制造印刷电路板,请写出![]() 溶液与铜反应的离子方程式______。
溶液与铜反应的离子方程式______。
③![]() 胶体制备实验:
胶体制备实验:
实验步骤:取一个小烧杯,加入25mL蒸馏水。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液。继续煮沸。
实验现象:烧杯中溶液呈_____色;化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是异辛烷的球棍模型:

(1)根据球棍模型,写出异辛烷的结构简式:________;异辛烷与乙烷的关系是__________。
(2)写出异辛烷完全燃烧的化学方程式:______________________ (异辛烷用分子式表示)。1 mol异辛烷和1 mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的物质的量之差是___mol。
(3)异辛烷的同分异构体有很多,其中一种同分异构体X的分子结构中含有6个甲基,则X的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确的是( )
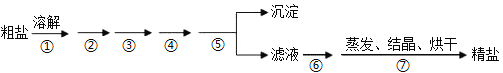
A.在第①步中使用玻璃棒搅拌可加速粗盐溶解
B.第⑤步操作是过滤
C.在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D.除去MgCl2的化学方程式为:MgCl2 + 2NaOH =Mg(OH)2↓+ 2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
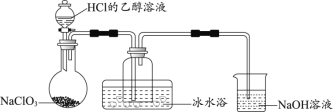
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O。
①冰水浴的作用是____________。
② NaOH溶液中发生的主要反应的离子方程式为________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到____,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-),需将其转化为Cl-除去。下列试剂中,可将ClO2-转化为Cl-的是_____________________(填字母序号)。
a. FeSO4 b. O3 c. KMnO4 d. SO2
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①上述制备K2FeO4反应的离子方程式为______________________。
②净水过程中,K2FeO4起到吸附、絮凝作用的原理是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为_______(填元素符号),其原因是___________________________。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
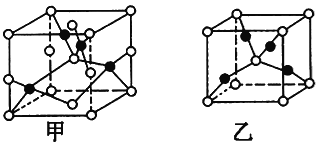
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为_____,乙为______;高温时,甲易转化为乙的原因为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
![]()
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃。则操作1~4分别是( )
A. 萃取、过滤、蒸馏、蒸馏 B. 过滤、分液、蒸馏、萃取
C. 过滤、蒸馏、过滤、蒸馏 D. 过滤、分液、过滤、蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com