
【题目】某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是
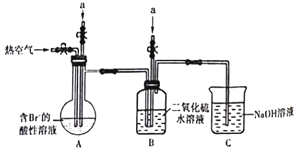
A.装置中通入的是a气体是Cl2
B.实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气
C.B装置中通入a气体前发生的反应为SO2+ Br2+2H2O===H2SO4+2HBr
D.C装置的作用只是吸收多余的二氧化硫气体
【答案】D
【解析】
实验室模拟工业上从浓缩海水中提取溴,由实验装置可知,a中气体为氯气,在A中氯气可氧化溴离子,利用热空气将溴单质吹出,B中通入气体为二氧化硫,在B中发生SO2+Br2+2H2O=H2SO4+2HBr,c中NaOH溶液可吸收溴、氯气、二氧化硫等尾气,以此来解答。
A.A装置中通入的a气体是Cl2,目的是氧化A中溴离子,故A正确;
B.实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气,热空气将溴单质吹出,故B正确;
C.B装置中通入b气体后发生的反应为SO2+Br2+2H2O=H2SO4+2HBr,故C正确;
D.C装置的作用为吸收溴蒸汽、氯气、二氧化硫等尾气,故D错误;
所以本题答案:D。


科目:高中化学 来源: 题型:
【题目】下列各项中I、II两个反应属于同一反应类型的是( )
选项 | 反应I | 反应II |
A |
| CH2=CH2→CH3CH2Cl |
B | CH3CH2Cl→CH3CH2OH | CH3CH2OH→CH3COOCH2CH3 |
C | CH3CH2OH→CH2=CH2 | CH3CH2OH→CH3CHO |
D | 油脂→甘油 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,有四种气体:①6.72 L CH4;②3.01×1023个HCl分子;③13.6g H2S;④0.2 mol NH3。下列有关比较中正确的是
A.体积大小:②>③>①>④
B.质量大小:②>③>④>①
C.氢原子数目多少:④>①>③>②
D.摩尔质量的大小:④>②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g·cm-3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
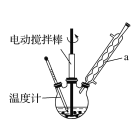
(1)装置a的名称是______________,为使反应体系受热比较均匀,可________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________________________。
(3)写出苯甲醛与银氨溶液在一定的条件下发生反应的化学方程式:________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过____________、__________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是______________(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1LpH=6的纯水中含有OH-的数目为10-8NA
B.当氢氧酸性燃料电池中转移2mol电子时被氧化的分子数为NA
C.0.5mol雄黄(As4S4,结构如图![]() ),含有NA个S—S键
),含有NA个S—S键
D.一定条件下向密闭容器中充入1molH2和2molH2(g)充分反应,生成HI分子数最多等于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,在工农业生产和国防上有重要用途。
(1)实验室利用硝石(NaNO3)和浓硫酸共热制取硝酸。
①该反应利用了浓硫酸的_______性;
②该反应的温度不宜太高,原因是(用化学方程式表示)______;
(2)工业上用氨气的催化氧化法制取硝酸,再利用硝酸和氨气反应生产NH4NO3。
①写出氨气的电子式_____;
②写出氨气催化氧化的化学方程式_______;
③在生产过程中,氨催化氧化生成氮氧化物的利用率是80%,氮氧化物被吸收得到硝酸的利用率是85%,则制取80 t的NH4NO3需要氨气______t;
(3)某混合酸1L中含1mol的硝酸和2mol的硫酸。取该混合酸100mL,加入5.6g铁粉充分反应。
①反应中可以生成NO____L(标准状况);
②向反应后的溶液再加入铁粉,能继续溶解铁粉____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计以下的实验方案,测定镁铝合金中铝的质量分数。
方案一:将m1g镁铝合金中溶解在足量的试剂X中,充分反应后,过滤、洗涤、干燥、称量,得到质量为m2 g的固体。
(1)试剂X是_____,反应的离子方程式是____;
(2)如果在实验的过程中,没有对固体进行洗涤,则测得铝的质量分数将_____(填“偏大”“偏小”或“无影响”)。
方案二:选择如图所示的装置和药品。

(3)组装完仪器以后,需要进行的实验操作是_____;
(4)导管a的作用是______;
(5)读数时需要注意的事项有_____;
(6)如果合金的质量是a g,测得气体的体积为b L(已换算为标准状况时的体积),则合金中铝的质量分数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
A.NaH与H2O反应生成氢气,每生成0.6g氢气转移电子数为0.6NA
B.12g镁在空气中充分燃烧,电子转移数目为NA
C.0.1 mol熔融NaHSO4中含有阳离子数目为0.1NA
D.标准状况下,6.72 L O2和N2的混合气体含有的原子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )

A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com