
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1LpH=6的纯水中含有OH-的数目为10-8NA
B.当氢氧酸性燃料电池中转移2mol电子时被氧化的分子数为NA
C.0.5mol雄黄(As4S4,结构如图![]() ),含有NA个S—S键
),含有NA个S—S键
D.一定条件下向密闭容器中充入1molH2和2molH2(g)充分反应,生成HI分子数最多等于2NA
【答案】B
【解析】
A.纯水中氢离子和氢氧根离子浓度相等,所以pH=6的纯水中,氢氧根离子浓度为l×10-6mol/L,1L纯水中含有的OH-数目为l×10-6NA,故A错误;
B. 氢氧燃料电池在酸性条件下,负极的电极反应式为:H2-2e-=2H+,正极的电极反应式为:4H++O2+4e-=2H2O,当转移2mol电子时,被氧化的分子数为NA,故B正确;
C. 由雄黄的结构简式:![]() 可知,结构中不存在S—S ,所以C错误;
可知,结构中不存在S—S ,所以C错误;
D. 因为H2+I2![]() 2HI为可逆反应,所以一定条件下向密闭容器中充入1molH2和2molI2(g)充分反应,生成HI分子数小于2NA,故D错误;
2HI为可逆反应,所以一定条件下向密闭容器中充入1molH2和2molI2(g)充分反应,生成HI分子数小于2NA,故D错误;
所以本题答案:B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:c.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。

①图中的错误是___________________。
②根据计算得知,所需NaOH的质量为_______。
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。容量瓶用蒸馏洗涤后残留有少量的水_______;若定容时俯视刻度线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“质量摩尔浓度”也是一种表示溶液组成的物理量,溶质B的质量摩尔浓度是用单位质量的溶剂中所含溶质B的物质的量来表示溶液组成的物理量,单位为molkg-1或molg-1,已知20°C时质量分数为20%的NaOH溶液的密度为1.16 gcm-3,则该溶液的质量摩尔浓度为
A.6.25 molkg-1B.4.25 molkg-1C.6.25 molg-1D.4.25 molg-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中甲、乙、丙表示某动物细胞中的不同化合物,下列叙述正确的是( )

A. 核糖核苷酸是构成物质甲的基本单位
B. 物质甲为该生物的主要遗传物质
C. 物质丙是构成细胞的基本骨架
D. 物质乙的种类和数量与细胞膜的功能密切相关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。
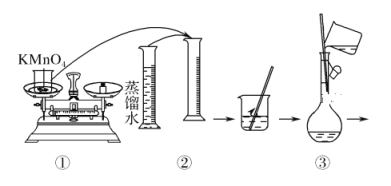
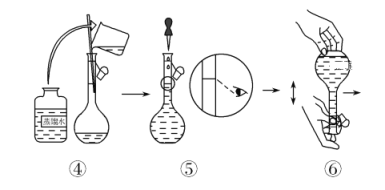
(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是
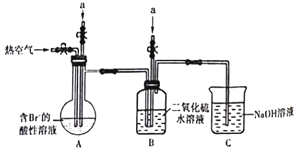
A.装置中通入的是a气体是Cl2
B.实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气
C.B装置中通入a气体前发生的反应为SO2+ Br2+2H2O===H2SO4+2HBr
D.C装置的作用只是吸收多余的二氧化硫气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在______ molAl2(SO4)3中含0.3molSO42- ,含Al3+约_______________个。
(2)标况下,11.2LNH3的质量为:____________g。
(3)20g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是_________。
(4)在100mLFe2(SO4)3溶液中含Fe3+11.2 g,则溶液中Fe3+浓度____________,取该溶液25ml加水稀释至300mL,则此时稀溶液中SO42﹣的物质的量浓度为____________。
(5)在标况下,22.4L由氮气和氧气组成的混合气体,其质量为30g,则氧气的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
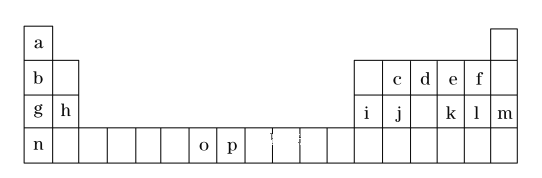
试回答下列问题:
①表中碱性最强的为_______(写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
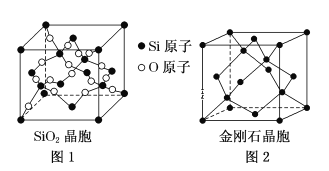
①推测SiO2晶胞中Si采用______杂化,O—Si—O的键角为___________。
②一个SiO2晶胞中,含有_______个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏伽德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:

(1)由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是_ ___。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为____。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com