
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:c.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。

①图中的错误是___________________。
②根据计算得知,所需NaOH的质量为_______。
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。容量瓶用蒸馏洗涤后残留有少量的水_______;若定容时俯视刻度线______。
【答案】容量瓶 c 蒸馏烧瓶支管口 f 未用玻璃棒引流 2.0g 无影响 偏高
【解析】
(1)根据装置图判断仪器c的名称;
(2)容量瓶使用前需检查是否漏水;
(3)分离互溶的液体用蒸馏的方法,据此分析;
(4)①向容量瓶中转移液体时用玻璃棒引流;
②根据m=cVM计算溶质的质量;
(5)容量瓶用蒸馏洗涤后残留有少量的水,对所配溶液的浓度没有影响;定容时俯视刻度线,读得的体积偏小;
(1)根据装置图可知仪器c为容量瓶;
(2)容量瓶使用前需检查是否漏水;
(3)分离互溶的液体用蒸馏的方法,温度计测量的是蒸气的温度,应放在蒸馏烧瓶的支管口处;冷凝水进出水方向为“下进上出”,因此出水口为f口;
(4)①向容量瓶中转移液体时应用玻璃棒引流;
②实验室没有450ml的容量瓶,应选择500ml的,因此溶质NaOH的质量m=cVM=0.1mol/L×0.5L×40g/mol=2.0g;
(5)容量瓶用蒸馏洗涤后残留有少量的水,对所配溶液的浓度没有影响;定容时俯视刻度线,读得的体积偏小,导致溶液的浓度偏高。


科目:高中化学 来源: 题型:
【题目】聚碳酸酯( )的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(
)的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(![]() )与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
)与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
A. Y的分子结构中有2个酚羟基 B. Y的分子式为C15H18O2
C. X的核磁共振氢谱有1个吸收峰 D. X、Y生成聚碳酸酯发生的是缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)标准状况下,1.7 g NH3与_______L H2S气体含有的氢原子数相同。
(2)2 mol的CO2与3 mol的SO3的原子数之比是__________。
(3)常温常压下22.4升CO2中分子个数___64克SO2的分子个数(填“>、<或=”)
(4)标准状况下,33.6L的NH3所含电子的物质的量约为______mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为__________mol/L
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为________。
(6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2molL﹣1、0.25molL﹣1、0.4molL﹣1,则c(SO42﹣)=__________.
(7)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为_________________,NH3的体积分数为______________.
(9)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是_____________mol/L。
Ⅱ.请按照要求完成下列方程式。
(1)写出泡沫灭火器反应原理的离子方程式:_______________________________________。
(2)铁与水蒸气高温下反应的化学方程式:____________________________________________。
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应的离子方程式:___________________________________。
(4)亚硝酸盐是毒性较强的物质,其具有较强的还原性,将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液(橙色)中,溶液由橙色变为绿色(Cr3+),试写出反应的离子方程式:__________________________。
(5)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:

(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42-、Ca2+离子,依次加入的试剂及其用量是______________、_______________、过滤、_______________。
(2)已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
①写出装置I中反应的化学方程式_____________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)若制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g,则该纯碱的纯度(质量分数)为__________(用m、b来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是

A. 原混合物中n[Ba(OH)2]:n[NaOH] =1:2
B. 横坐标轴上p点的值为90
C. b点时溶质为NaHCO3
D. ab段发生反应的离子方程式依次为:CO2+2OH- = H2O+CO32-,CO2+H2O+ CO32-=2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中I、II两个反应属于同一反应类型的是( )
选项 | 反应I | 反应II |
A |
| CH2=CH2→CH3CH2Cl |
B | CH3CH2Cl→CH3CH2OH | CH3CH2OH→CH3COOCH2CH3 |
C | CH3CH2OH→CH2=CH2 | CH3CH2OH→CH3CHO |
D | 油脂→甘油 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式为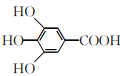 ,下列关于没食子酸的说法正确的是
,下列关于没食子酸的说法正确的是
A. 分子式为C7H7O5
B. 能发生加成反应,消去反应和取代反应
C. 1 mol没食子酸与足量的碳酸氢钠反应,生成4 mol CO2
D. 1 mol没食子酸与足量的钠反应,生成2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5g氯化氢溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A. 所得溶液的物质的量浓度为1mol·L-1B. 36.5g氯化氢含有NA个原子
C. 36.5gHCl气体占有的体积约为22.4LD. 所得溶液的质量分数w=36.5c/1000ρ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1LpH=6的纯水中含有OH-的数目为10-8NA
B.当氢氧酸性燃料电池中转移2mol电子时被氧化的分子数为NA
C.0.5mol雄黄(As4S4,结构如图![]() ),含有NA个S—S键
),含有NA个S—S键
D.一定条件下向密闭容器中充入1molH2和2molH2(g)充分反应,生成HI分子数最多等于2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com