
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:

(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42-、Ca2+离子,依次加入的试剂及其用量是______________、_______________、过滤、_______________。
(2)已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
①写出装置I中反应的化学方程式_____________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)若制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g,则该纯碱的纯度(质量分数)为__________(用m、b来表示)。
【答案】过量BaCl2溶液 过量Na2CO3溶液 适量(过量)稀盐酸 NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+H2O+CO2 ↑ CO2 取少量纯碱样品,加入足量的稀硝酸,再加入硝酸银溶液,若生成白色沉淀,则说明含有氯离子。
Na2CO3+H2O+CO2 ↑ CO2 取少量纯碱样品,加入足量的稀硝酸,再加入硝酸银溶液,若生成白色沉淀,则说明含有氯离子。 ![]() ×100%
×100%
【解析】
(1)工业上除去SO42-用含有Ba2+的可溶性盐、除去Ca2+用含有CO32-的可溶性盐;
(2)①NaCl、CO2、NH3、H2O发生反应生成NaHCO3和NH4Cl;
②受热条件下,碳酸氢钠分解生成碳酸钠、二氧化碳和水;
(3)装置II中得到二氧化碳,装置I中需要二氧化碳;
(4)①Cl-的检验常用硝酸酸化的硝酸银溶液,生成不溶于稀硝酸的AgCl沉淀;
②向m克纯碱样品中加入足量CaCl2溶液反应生成碳酸钙,则最后得到的bg为碳酸钙的质量,根据碳原子守恒由碳酸钙的物质的量可得到碳酸钠的物质的量,在求算出理论上碳酸钠的质量,进而求算纯碱的纯度。
(1)除去饱和食盐水的中SO42-要用BaCl2溶液,除去饱和食盐水的中Ca2+要用Na2CO3溶液,并且除杂时试剂应该过量,最后用稀盐酸调节pH=7,
故答案为:足量BaCl2溶液、足量Na2CO3溶液、适量稀盐酸;
(2)①先向食盐水中通入NH3使溶液呈碱性,CO2、NH3和H2O反应生成NH4HCO3,由于溶解度小NaHCO3,所以NaCl和NH4HCO3反应生成NaHCO3和NH4Cl,即
NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,
故答案为:NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl;
②NaHCO3对热不稳定,受热易分解生成Na2CO3、H2O、CO2,化学方程式为2NaHCO3![]() Na2CO3+H2 O+CO2 ↑,
Na2CO3+H2 O+CO2 ↑,
故答案为:2NaHCO3![]() Na2CO3+H2O+CO2 ↑;
Na2CO3+H2O+CO2 ↑;
(3)装置II中得到二氧化碳,装置I中需要二氧化碳,所以能循环利用的是二氧化碳,故答案为:CO2;
(4)①Cl-的检验常用硝酸酸化的硝酸银溶液,方法为:取少量纯碱样品溶于水,加入足量的稀硝酸,再加入硝酸银溶液,若生成白色沉淀,则说明其中含有氯离子;
故答案为:取少量纯碱样品溶于水,加入足量的稀硝酸,在加入硝酸银溶液,若生成白色沉淀,则说明其中含有Cl-;
②向m克纯碱样品中加入足量CaCl2溶液反应生成碳酸钙,则最后得到的bg为碳酸钙的质量,则根据碳原子守恒,碳酸钠的物质的量=碳酸钙的物质的量=![]() =
=![]() ,则碳酸钠的质量=nM=
,则碳酸钠的质量=nM=![]() ×106g/mol=
×106g/mol=![]() g,则该纯碱的纯度=
g,则该纯碱的纯度=![]() ×100%=
×100%=![]() ×100%;
×100%;
答案为:![]() ×100%。
×100%。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.1.0 mol·L-1的KNO3溶液:H+,Fe2+,Cl-,![]()
B.石蕊溶液呈红色的溶液:![]() ,Ba2+,
,Ba2+,![]() ,Cl-
,Cl-
C.pH=12的溶液:K+,Na+,CH3COO-,Br-
D.与铝反应产生大量氢气的溶液:Na+,K+,![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯环上的羟基具有酸性。下列关于有机化合物M和N的说法正确的是( )
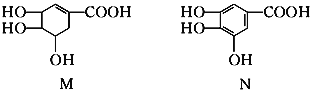
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.M、N分子中都含有苯环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为三套实验装置。

(1)写出下列仪器的名称:a.__________,b._____________。
(2)若利用装置1分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,冷凝水由________(填f或g) 口通入。
(3)用装置II分离混合物时,为使液体顺利流下,应进行的操作是_______________。
(4)实验室用Na2CO3·10H2O 晶体配制0.05mol/L 的Na2CO3 溶液970mL。
①应用托盘天平称取Na2CO3·10H2O 的质量是____g。
②装置III是某同学转移溶液的示意图。图中的错误是_______________。
③除了图中给出的仪器和托盘天平以及烧杯外,为完成实验还需要的仪器有:______________。
Ⅱ利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
(1)溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在________中溶解,完全溶解后,全部转移至100 mL的________中,加蒸馏水至________。
(2)滴定:取0.00950 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+===3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-===S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液______,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从粉煤灰(含莫来石、石英等)中回收![]() 的一种工艺流程如下:
的一种工艺流程如下:
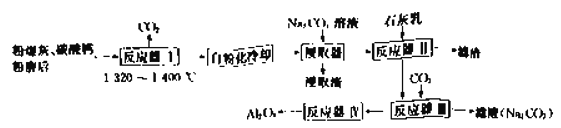
(1)经反应器I可使莫来石和石英转化为![]() (硅酸二钙)和______________(七铝十二钙,填化学式),从而使其中的
(硅酸二钙)和______________(七铝十二钙,填化学式),从而使其中的![]() 得到活化。
得到活化。
(2)控制条件,经反应器I烧结后固体自身不需要机械加工即可变成粉末,“自粉化”的意义是_______。
(3)浸取器中,适量增大![]() 溶液的投料,有利于提高铝酸钙转化为
溶液的投料,有利于提高铝酸钙转化为![]() 的产率,其原因是_______________________________________;同时有少量硅进入浸取渣,硅的存在形式是________________________________(填化学式)。
的产率,其原因是_______________________________________;同时有少量硅进入浸取渣,硅的存在形式是________________________________(填化学式)。
(4)反应器Ⅲ中发生反应的离子方程式为:__________________________________。
(5)反应器Ⅳ采取工艺方法是_____________________;上述工艺流程中可以循环使用的物质是_______________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A.H2O+CaO=Ca(OH)2
B.2H2O+2F2=4HF+O2
C.2H2O![]() O2↑+2H2↑
O2↑+2H2↑
D.3NO2+ H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:c.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。

①图中的错误是___________________。
②根据计算得知,所需NaOH的质量为_______。
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。容量瓶用蒸馏洗涤后残留有少量的水_______;若定容时俯视刻度线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为______________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为____,C原子的杂化形式为______。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中甲、乙、丙表示某动物细胞中的不同化合物,下列叙述正确的是( )

A. 核糖核苷酸是构成物质甲的基本单位
B. 物质甲为该生物的主要遗传物质
C. 物质丙是构成细胞的基本骨架
D. 物质乙的种类和数量与细胞膜的功能密切相关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com