
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A.H2O+CaO=Ca(OH)2
B.2H2O+2F2=4HF+O2
C.2H2O![]() O2↑+2H2↑
O2↑+2H2↑
D.3NO2+ H2O=2HNO3+NO
科目:高中化学 来源: 题型:
【题目】五水硫代硫酸钠(化学式为Na2S2O3 5H20)不溶于乙醇,易溶于水,可用于鞣制皮革、矿石提银、水产养殖、医疗解毒等,工业上常用Na2S、Na2CO3为原料制备,其生产流程如下图所示,回答下列问题。

(1)五水硫代硫酸钠中硫元素的化合价为__________。常温下,Na2S溶液的pH_______7(选填“>”、“<”或“=”)。
(2)溶解原料的蒸馏水需加热煮沸一段时间后待用,其目的是____________。
(3)Na2S和Na2CO3按物质的量比2:1投料后加热,将S02缓缓通入溶液中,即可获得 Na2S203,反应的化学方程式为___________________________。
(4)上述制备实验一般须控制在碱性环境下进行,若在酸性条件下产品会发黄,用离子方程式表示其可能的原因___________________________。
(5)充分反应后趁热过滤,将滤液水浴加热浓缩,冷却析出后用乙醇洗涤表面,即可获得纯净的无色透明晶体。趁热过滤和用乙醇洗涤的目的是 ___________________________。
(6)为测定产品中Na2S2O3 5H2O的纯度,准确称取样品质量,用适量的蒸馏水溶解,加入指示剂用已知浓度的碘的标准溶液滴定。
反应原理为:2S2O32-+I2= S4O62-+2I-
①加入的指示剂为______________________(填名称)。
②滴定至终点时,溶液颜色的变化______________________。
③该实验中,滴加标准碘液的操作正确的是________________________________(填图中对应操作的字母编号)。

④下列操作可使产品纯度检测值偏髙的是___________(选填编号)。
a.装标准液的滴定管水洗后未润洗
b.滴定过程中出现漏液
c.滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的SO2和SO3,它们之间的关系正确的是
A.所含硫原子的物质的量之比为1:1
B.所含硫元素的质量比为5:4
C.所含氧元素的质量比为4:5
D.所含氧原子的物质的量之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是

A. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
B. 常温下,PbI2的Ksp为2×10-6
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

![]() 该浓盐酸的物质的量浓度为 ______
该浓盐酸的物质的量浓度为 ______ ![]() .
.
![]() 取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 ______ .
取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 ______ .
A.溶液中HCl的物质的量![]() 溶液的浓度
溶液的浓度
C.溶液中![]() 的数目
的数目![]() 溶液的密度
溶液的密度
![]() 某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为
某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为![]() 稀盐酸.
稀盐酸.
![]() 该学生需要量取 ______ mL上述浓盐酸进行配制.
该学生需要量取 ______ mL上述浓盐酸进行配制.
![]() 配制时,其正确的操作顺序是
配制时,其正确的操作顺序是![]() 用字母表示,每个字母只能用一次
用字母表示,每个字母只能用一次![]() ______ ;
______ ;
A.用30mL水洗涤烧杯![]() 次,洗涤液均注入容量瓶,振荡
次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水![]() 约
约![]() 的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线![]() 处
处
![]() 在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?![]() 填“偏高”或“偏低”或“无影响”
填“偏高”或“偏低”或“无影响”![]() .
.
I、用量筒量取浓盐酸时俯视观察凹液面 ______
II、用量筒量取浓盐酸后,洗涤量筒![]() 次,洗涤液也转移到容量瓶 ______
次,洗涤液也转移到容量瓶 ______
III、溶液注入容量瓶前没有恢复到室温就进行定容 ______
![]() 若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为d
若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为d![]() ,则此溶液的物质的量浓度为 ______
,则此溶液的物质的量浓度为 ______ ![]() 填字母
填字母![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,被称为“黑金”的“新材料之王”石墨烯将“彻底改变21世纪”。中国华为研发人员利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,已在世界上率先开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是

A. 有设计师建议该电池采用隔膜效果更好,可选用质子交换膜
B. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe=Li1-xCoO2+xLi+
C. 石墨烯电池通过提高储锂容量进而提高能量密度,废旧的该电池进行“放电处理”让Li+嵌入LiCoO2中而有利于回收
D. 石墨烯电池充电时LiCoO2极与电源负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:

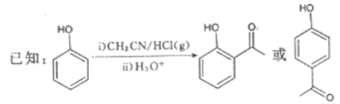
回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修3:物质结构与性质)
(1)![]() 中
中![]() 原子的杂化轨道类型为____________,
原子的杂化轨道类型为____________,![]() 分子空间构型为________________。
分子空间构型为________________。
(2)已知:硼酸的电离方程式为![]() ,试依据上述反应写出
,试依据上述反应写出![]() 的结构式____________________。
的结构式____________________。
(3)钛铁矿经过![]() 等多种物质处理后会生成
等多种物质处理后会生成![]() 等中间产物。
等中间产物。
①![]() 晶体中存在_________________(填字母代号)。
晶体中存在_________________(填字母代号)。
A. 离子键 B. ![]() 键 C.
键 C. ![]() 键 D.氢键
键 D.氢键
②![]() 为粘稠状、难挥发性的强酸,而
为粘稠状、难挥发性的强酸,而![]() 是易挥发性的强酸,其原因是____________________。
是易挥发性的强酸,其原因是____________________。
(4)![]() 是离子晶体,其晶格能可通过下图的
是离子晶体,其晶格能可通过下图的![]() 循环计算得到。
循环计算得到。
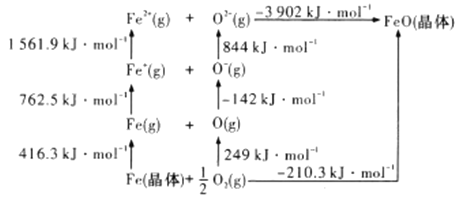
可知,![]() 原子的第一电子亲和能为___________
原子的第一电子亲和能为___________![]() ,
,![]() 晶格能为______________
晶格能为______________![]() 。
。
(5)![]() 可用于制造高温发热元件,其在高温时具有立方晶型,晶胞如图所示。
可用于制造高温发热元件,其在高温时具有立方晶型,晶胞如图所示。

已知晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则
,则![]() 原子与
原子与![]() 原子之间的最短距离为_______
原子之间的最短距离为_______![]() ;
;![]() 的密度为_______________________
的密度为_______________________![]() (列式表示)。
(列式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com