
【题目】(化学---选修3:物质结构与性质)
(1)![]() 中
中![]() 原子的杂化轨道类型为____________,
原子的杂化轨道类型为____________,![]() 分子空间构型为________________。
分子空间构型为________________。
(2)已知:硼酸的电离方程式为![]() ,试依据上述反应写出
,试依据上述反应写出![]() 的结构式____________________。
的结构式____________________。
(3)钛铁矿经过![]() 等多种物质处理后会生成
等多种物质处理后会生成![]() 等中间产物。
等中间产物。
①![]() 晶体中存在_________________(填字母代号)。
晶体中存在_________________(填字母代号)。
A. 离子键 B. ![]() 键 C.
键 C. ![]() 键 D.氢键
键 D.氢键
②![]() 为粘稠状、难挥发性的强酸,而
为粘稠状、难挥发性的强酸,而![]() 是易挥发性的强酸,其原因是____________________。
是易挥发性的强酸,其原因是____________________。
(4)![]() 是离子晶体,其晶格能可通过下图的
是离子晶体,其晶格能可通过下图的![]() 循环计算得到。
循环计算得到。
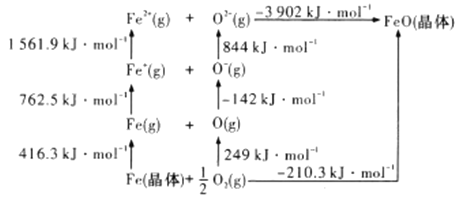
可知,![]() 原子的第一电子亲和能为___________
原子的第一电子亲和能为___________![]() ,
,![]() 晶格能为______________
晶格能为______________![]() 。
。
(5)![]() 可用于制造高温发热元件,其在高温时具有立方晶型,晶胞如图所示。
可用于制造高温发热元件,其在高温时具有立方晶型,晶胞如图所示。

已知晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则
,则![]() 原子与
原子与![]() 原子之间的最短距离为_______
原子之间的最短距离为_______![]() ;
;![]() 的密度为_______________________
的密度为_______________________![]() (列式表示)。
(列式表示)。
【答案】![]() 平面正三角形
平面正三角形 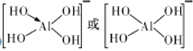
![]()
![]() 分子之间容易形成氢键,而
分子之间容易形成氢键,而![]() 易形成分子内氢键,造成分子间作用力减弱,易挥发 142 3902
易形成分子内氢键,造成分子间作用力减弱,易挥发 142 3902 ![]() 或
或![]()
![]()
【解析】
综合应用杂化、分子空间构型、化学键、第一电子亲合能、晶格能、氢键、晶胞等概念或理论分析解答问题。
(1)![]() 分子中,中心原子
分子中,中心原子![]() 的价层电子对数为(3+3)/2=3,即B原子形成3个
的价层电子对数为(3+3)/2=3,即B原子形成3个![]() 键,没有孤对电子,
键,没有孤对电子,![]() 原子的杂化轨道类型为
原子的杂化轨道类型为![]() 杂化,
杂化,![]() 分子空间构型为平面三角形。
分子空间构型为平面三角形。
(2)![]() 和
和![]() 位于同一主族,形成化合物的结构具有相似性,
位于同一主族,形成化合物的结构具有相似性,![]() 的结构式为
的结构式为
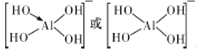 。
。
(3)①![]() 晶体中,TiO2+、SO42-之间有离子键,阴、阳离子内都有
晶体中,TiO2+、SO42-之间有离子键,阴、阳离子内都有![]() 键,SO42-内硫原子的3d空轨道接受氧原子的孤电子对形成d-p
键,SO42-内硫原子的3d空轨道接受氧原子的孤电子对形成d-p ![]() 配键(超中学要求),故选ABC。
配键(超中学要求),故选ABC。
②![]() 形成分子间氢键,增强了分子间相互作用,使其难挥发。而
形成分子间氢键,增强了分子间相互作用,使其难挥发。而![]() 形成分子内氢键,减弱了分子间相互作用,故其易挥发。
形成分子内氢键,减弱了分子间相互作用,故其易挥发。
(4)第一电子亲合能是指1mol气态原子获得电子形成负一价阴离子所放出的能量,图中![]() 原子的第一电子亲和能为142
原子的第一电子亲和能为142![]() ;离子晶体的晶格能是指气态阴阳离子形成1 mol离子晶体所放出的能量,图中
;离子晶体的晶格能是指气态阴阳离子形成1 mol离子晶体所放出的能量,图中![]() 晶格能为3092
晶格能为3092![]() 。
。
(5)![]() 中Zr、O元素的化合价分别是+4、-2价,晶胞中Zr的配位数为8,则O的配位数为4,即氧原子位于最邻近的4个锆原子围成的正四面体中心。若晶胞体心有一个锆原子,则晶胞体对角线为
中Zr、O元素的化合价分别是+4、-2价,晶胞中Zr的配位数为8,则O的配位数为4,即氧原子位于最邻近的4个锆原子围成的正四面体中心。若晶胞体心有一个锆原子,则晶胞体对角线为![]() 、
、![]() 原子之间最短距离的4倍。故
原子之间最短距离的4倍。故![]() 原子与
原子与![]() 原子之间的最短距离为
原子之间的最短距离为![]() nm=
nm=![]() nm。
nm。
1个晶胞有4个“![]() ”,质量m=(4/NA)×123g,体积V=(a×10-7cm)3,故密度ρ=m/V=
”,质量m=(4/NA)×123g,体积V=(a×10-7cm)3,故密度ρ=m/V=![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A.H2O+CaO=Ca(OH)2
B.2H2O+2F2=4HF+O2
C.2H2O![]() O2↑+2H2↑
O2↑+2H2↑
D.3NO2+ H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池,下图为某种锂离子电池放电时有关离子转化关系。下列有关说法正确的是
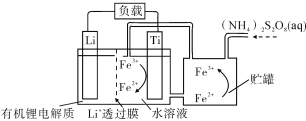
A. 电池中Li+透过膜两侧的电解质可以互换
B. 充电时,Li+通过Li+透过膜从右侧向左侧移动
C. 充电时,钛电极作阴极,电极反应式为:Fe3++e===Fe2+
D. 放电时,进入贮罐的液体发生的离子反应方程式为:S2O82-+Fe2+===Fe3++2SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水是氯碱工业的基础,下图是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水,通电几分 钟后,将湿润的淀粉碘化钾试纸放在A电极一端的管口,试纸变蓝色,请回答:
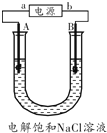
(1)b端为电源的_______极;请用化学方程式解释使湿润的淀粉淀化钾试纸变蓝的原因_____________
(2)写出B极的电极反应式_______
(3)若在U形管的两端分别滴加无色酚酞溶液,则一段时间后_____极(填“A”或“B”)呈红色
(4)请写出电解饱和食盐水的化学方程式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)“酸浸”应选择_________(填标号);为提高酸浸率,可采取的措施_________(至少答两点)
a. 硫酸 b. 盐酸 c. 硝酸
(2)实验室要完成操作1需要的玻璃仪器有_________。
(3)加入H2C2O4溶液时,发生的反应为______+______TiCl4+_____H2C2O4+ _____H2O= BaTiO(C2O4)2·4H2O↓ + _________;可循环使用的物质X是(写名称)_________。
(4)请简述检验草酸氧钛钡晶体是否洗涤干净的方法_________。
(5)高温煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成的气体产物有CO、和_________。
(6)测定钛酸钡粉体中BaTiO3的质量分数。
已知:Ba2++CrO42-=BaCrO4↓ 2CrO42-+2H+=Cr2O72-+H2O
现取a g煅烧后的BaTiO3粉末酸溶得到100.0 mL含Ba2+的溶液,取25.00 mL于锥形瓶,加入x mL 浓度为C1 mol/L的Na2CrO4溶液(Na2CrO4过量)充分反应后,用浓度为C2 mol/L标准盐酸滴定至CrO42-被完全反应,消耗盐酸体积为y mL。(钛元素不干扰测定过程)已知BaTiO3的摩尔质量为M g/mol,试写出粉体中BaTiO3质量分数的表达式。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
B. 标准状况下,2.24 L乙烷和丙烯的混合物中含氢原子数目为0.6NA
C. 将0.1 mol H2和0.2 mol I2(g)充入密闭容器中充分反应后,生成的H-I键数目为0.2NA
D. 常温下,电解1 L的精制食盐水,一段时间后测得溶液pH为11,则电解过程中通过导线的电子数目为0.002NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,该电池能长时间保持稳定的放电电压,放电时的总反应为:3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH,下列判断不正确的是
A. 放电时,负极反应为Zn-2e-+2OH-===Zn(OH)2
B. 充电时,阴极pH增大
C. 充电时,阳极反应为Fe(OH)3+5OH-―3e-===FeO![]() +4H2O
+4H2O
D. 放电时,每转移6mol电子,则有1 mol K2FeO4被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据美国、日本、加拿大等国统计,每年因金属腐蚀造成损失占国民经济总值1%,是地震、风灾、火灾损失的总和。下图是某研究小组的金属腐蚀探究实验装置图。

(1)酸雨浸泡过的铁钉置于试管中(如图),一段时间后,如果U形管中红墨水液面左高右低,则铁钉发生了(_______)(填“A”或“B”),如果U形管内液面左低右高,则铁钉发生了(_______)(填“A”或“B”)。
A.析氢腐蚀 B. 吸氧腐蚀
研究小组发现开始一段时间,U形管内液面左低右高,再过一段时间右边液面不仅没有继续升高,反而有回落的趋势(装置气密性良好),造成这一现象的原因是___________。
(2)若将铁钉换成含杂质炭的锌块,并在试管中加入少许氯化钠溶液,一段时间后,U形管内液面出现了左高右低的现象。试写出电极反应式,
负极____________________,
正极______________________________。
(3)若将锌块换成铜块(含杂质炭),并加入少许0.1mol/L的硫酸溶液,_______(填“能”或“不能”)发生析氢腐蚀;但一段时间后铜块明显发生了腐蚀,试写出其电极反应式:
负极_________________________,
正极________________________。
美国的“自由女神”是铜铸艺雕,表面因生铜绿而被腐蚀,写出空气中铜表面生成铜绿(Cu2(OH)2CO3)的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1mol·L-1的醋酸溶液至0.01mol·L-1,随着溶液的稀释,下列各项中始终保持增大趋势的是( )
A. B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com