
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
B. 标准状况下,2.24 L乙烷和丙烯的混合物中含氢原子数目为0.6NA
C. 将0.1 mol H2和0.2 mol I2(g)充入密闭容器中充分反应后,生成的H-I键数目为0.2NA
D. 常温下,电解1 L的精制食盐水,一段时间后测得溶液pH为11,则电解过程中通过导线的电子数目为0.002NA
【答案】B
【解析】
A.在Na2CO3溶液中CO32-由于水解而消耗,所以若溶液中CO32-总数为NA,则Na+总数大于2NA,A错误;
B.标准状况下,2.24 L乙烷和丙烯的混合物的物质的量是0.1mol,由于每种气体分子中都含有6个H原子,所以0.1mol混合气体中含有H原子数为0.6NA,B正确;
C.H2与I2化合形成HI的反应为可逆反应,所以将0.1 mol H2和0.2 mol I2(g)充入密闭容器中充分反应后,生成HI的物质的量小于0.2mol,则产生的H-I键数目少于0.2NA,C不正确;
D.根据电解方程式:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,根据方程式可知:每反应产生1molNaOH,反应转移1mol电子,现在反应产生NaOH的物质的量为n(NaOH)=10-3mol/L×1L=10-3mol,所以电解过程中通过导线的电子数目为0.001NA,D错误;
Cl2↑+H2↑+2NaOH,根据方程式可知:每反应产生1molNaOH,反应转移1mol电子,现在反应产生NaOH的物质的量为n(NaOH)=10-3mol/L×1L=10-3mol,所以电解过程中通过导线的电子数目为0.001NA,D错误;
故合理选项是B。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
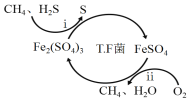
(1)过程i的离子反应方程式为_________________________________________。
(2)已知:
①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是_______<pH<_______,这样选择的原因是:_______________________________________________。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
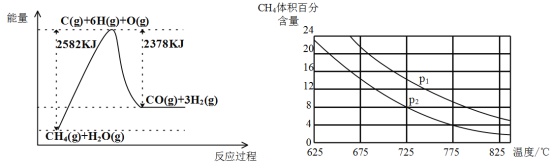
(3)①该过程的热化学方程式是__________________________________________。
②比较压强P1和p2的大小关系:P1 _________ P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1molCH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________(结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
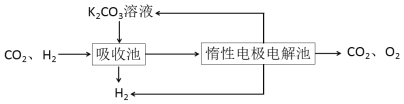
(4)吸收池中发生反应的离子方程式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B. 标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3NA
C. 过量铜与含0.4 mol HNO3的浓硝酸反应,电子转移数大于0.2NA
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把质量分数为98%密度为1.84g/cm3的浓H2SO4配制成500ml0.5mol/L的稀H2SO4,计算:
(1)浓H2SO4的物质的量浓度是多少?_____
(2)所需浓H2SO4的体积是多少?_____(写出相关公式及计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苦杏仁酸在医药工业可用于合成头孢羟唑、羟苄唑、匹莫林等的中间体,下列路线是合成苦杏仁酸及其衍生物的一种方法:

(1)试写出B的结构简式_____,C中官能团的名称为_____。
(2)反应①的反应类型为_____,D的核磁共振氢谱共有_____组峰。
(3)1molE最多可以与_____molNaOH反应。反应③的化学方程式为_____。
(4)两个C分子可以反应生成具有三个六元环的化合物F,则F的结构简式为_____。
(5)写出满足下列条件的C的同分异构体的结构简式_____。
A.既能发生银镜反应,又能发生水解反应
B.遇FeCl3能显紫色
C.苯环上具有两个位于对位的取代基
(6)已知:RCH2COOH![]() RCHClCOOH,请以冰醋酸为原料(无机试剂任选)设计制备聚乙醇酸(
RCHClCOOH,请以冰醋酸为原料(无机试剂任选)设计制备聚乙醇酸(![]() )的合成路线_____。
)的合成路线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
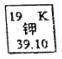
【题目】如图所示为元素周期表中钾元素框图,数据“39.10”表示的是________。
某化学兴趣小组欲除去16g固体氯化钠中混有的少量氯化钙和硫酸镁杂质,设计实验方案如下(已知常温下NaCl的溶解度为36g/100g![]() O)
O)

(1)加水溶解时,适合的取水量为________
A. 20mL B. 45mL C. 75mL D. 100mL
(2)为加快溶解速率,可采取的方法是________和________(任写2种)
(3)依次加入的过量试剂为________、________和________。
(4)溶液A中加入的适量酸为________,若该酸也加过量,对所得到氯化钠的纯度________(填“有”或“没有”)影响
(5)操作Ⅰ的名称是________;操作II的名称是________。两种操作中都用到的玻璃仪器是________。
(6)最后得到的固体氯化钠与原固体混合物中的氯化钠质量相比,结果________(填“增大”、“减小”或“不变”)。
(7)固体A中所含的盐的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s) ![]() C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. v(A)=2 mol·L-1·min-1 B. v(B)=1.2 mol·L-1·s-1
C. v(C)=0.1 mol·L-1·s-1 D. v(D)=0.4 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某草酸晶体(H2C2O42H2O)样品的纯度,现称取一定质量的该样品,配制成100 mL溶液,取25.00 mL该溶液于锥形瓶中,加适量稀硫酸,用0.100 mol/L的KMnO4溶液滴定(杂质不参与反应)。为省去计算过程,当称取的样品的质量为某数值时,滴定所用KMnO4溶液的毫升数恰好等于样品中草酸晶体的质量分数的100倍。则应称取样品的质量为
A. 2.25 g B. 3.15 g C. 9.00 g D. 12.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极__________________________ ;
②图中X溶液是_______________,
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
(2)如图是一个化学过程的示意图。

①甲池中OH-移向__________极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式_______________。
③乙池中总反应的离子方程式___________________。
④当乙池中B(A g)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液的C(H+)是___________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是______________(填序号)。A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com