
【题目】把质量分数为98%密度为1.84g/cm3的浓H2SO4配制成500ml0.5mol/L的稀H2SO4,计算:
(1)浓H2SO4的物质的量浓度是多少?_____
(2)所需浓H2SO4的体积是多少?_____(写出相关公式及计算过程)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是
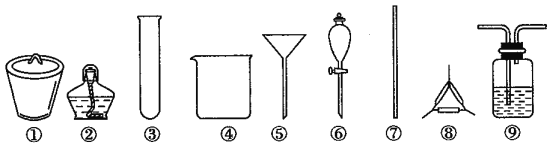
A. 制取氨气,可选用②③
B. 分离 NaHCO3,可选用④⑤⑦
C. 制取 Na2CO3,可选用①②⑦⑧
D. 制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1二元酸H2A溶液中滴加0.2 mol·L-l NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是( )
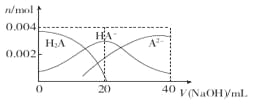
A. 当V(NaOH)="20" mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c( A2-)>c( OH-)> ((H+)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大
C. 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D. 当V(NaOH) ="40" mL时,升高温度,c(Na+)/c(A2-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境,提倡“低碳生活”,是我们都应关注的社会问题。
(1)目前,一些汽车已改用天然气(CNG)做燃料,以减少对空气污染。
①16g甲烷完全燃烧生成液态水放出890kJ热量,则甲烷燃烧的热化学方程式是__________。
②1mol碳完全燃烧生成二氧化碳气体放出393.5kJ热量,通过计算比较,填写下列表格(精确到0.01):
物质质量1g | 燃烧放出的热量/kJ | 生成CO2的质量/g |
碳 | 32.80 | ____________ |
甲烷 | ____________ | 2.75 |
根据表格中的数据,天然气与煤相比,用天然气做燃料的优点是__________。
(2)为了减少二氧化碳的排放,利用海藻可将二氧化碳、氢气转化成水及一种可以再生的绿色能源乙醇,该反应的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
B. 标准状况下,2.24 L乙烷和丙烯的混合物中含氢原子数目为0.6NA
C. 将0.1 mol H2和0.2 mol I2(g)充入密闭容器中充分反应后,生成的H-I键数目为0.2NA
D. 常温下,电解1 L的精制食盐水,一段时间后测得溶液pH为11,则电解过程中通过导线的电子数目为0.002NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为: N2(g)+3H2(g)![]() 2NH3(g) ΔH= - 92.4 kJ·mol-1.
2NH3(g) ΔH= - 92.4 kJ·mol-1.
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ(填“小于”,“大于”或“等于”)。
(2)当反应达到平衡时,N2和H2的浓度比是_________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将____(填“正向”、“逆向”或“不”)移动。
II.该反应在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

(1)t1时刻,体系中发生变化的条件是_______ 。
A.增大压强B.升高温度C.减小压强D.降低温度 E.加入正催化剂
(2)下列时间段中,氨的百分含量最高的是_______。
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如图: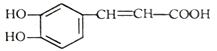 ,下列说法不正确的是
,下列说法不正确的是
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol咖啡酸最多能与4molH2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A的分子式为C8H12O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com