
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
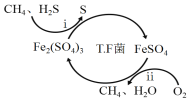
(1)过程i的离子反应方程式为_________________________________________。
(2)已知:
①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是_______<pH<_______,这样选择的原因是:_______________________________________________。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
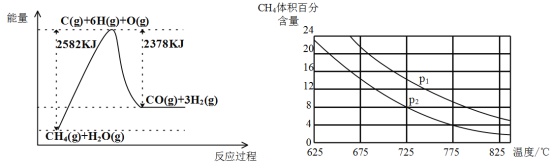
(3)①该过程的热化学方程式是__________________________________________。
②比较压强P1和p2的大小关系:P1 _________ P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1molCH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________(结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
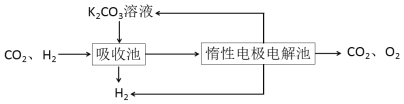
(4)吸收池中发生反应的离子方程式是____________________________________。
【答案】H2S+2Fe3+=2Fe2++S↓+2H+ 1.5 1.9 此范围既保证了Fe2+有较快的氧化速率又防止生成的Fe3+形成沉淀 CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+204kJ/mol > 0.48 CO32-+CO2+H2O=2HCO3-
【解析】
(1)由图可知,过程中H2S变成S,S元素化合价由-2价变成0价,Fe3+被还原变成Fe2+,根据电子守恒写出离子反应方程式;
(2)由①可知Fe3+在pH=l.9时开始沉淀,会导致Fe3+浓度降低,则Fe2+ 和Fe3+浓度均会降低,速率降低,故pH应小于1.9。由②可知,pH在1.5的时候的氧化速率较快,故pH的取值范围是1.5<pH<1.9。
(3)①由图可知该反应为吸热反应,△H=2582kJ/mol-2378kJ/mol=+204kJ/mol,该过程的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+204kJ/mol;
②由图可知,温度一定,压强也大,平衡逆向移动,则CH4的体积分数增大,则
P1 > P2。
③列出三行式,根据起始时混合气的密度是平衡时混合气密度的1.4倍,求出平衡时,CH4、H2O、CO、H2的浓度,再根据平衡常数K=![]() 计算。
计算。
(4)由图示已知吸收池中用的是K2CO3溶液,吸收CO2,以此书写离子方程式。
(1)由图可知,过程中H2S变成S,S元素化合价由-2价变成0价,Fe3+被还原变成Fe2+,根据电子守恒,过程i的离子反应方程式为H2S+2Fe3+=2Fe2++S↓+2H+;
因此,本题正确答案是:H2S+2Fe3+=2Fe2++S↓+2H+;
(2)由①可知Fe3+在pH=l.9时开始沉淀,会导致Fe3+浓度降低,则Fe2+ 和Fe3+浓度均会降低,速率降低,故pH应小于1.9。由②可知,pH在1.5的时候的氧化速率较快,故pH的取值范围是1.5<pH<1.9。
因此,本题正确答案是:1.5;1.9;此范围既保证了Fe2+有较快的氧化速率又防止生成的Fe3+形成沉淀;
(3)①由图可知该反应为吸热反应,△H=2582kJ/mol-2378kJ/mol=+204kJ/mol,该过程的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+204kJ/mol;
②由图可知,温度一定,压强增大,平衡逆向移动,则CH4的体积分数增大,则
P1 > P2。
③列出三行式,设转化的CH4的物质的量为x,
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始(mol) 1 1 0 0
变化(mol) x x x 3x
平衡(mol)1-x 1-x x 3x
根据起始时混合气的密度是平衡时混合气密度的1.4倍,气体的总质量不变,密度与气体的总物质的量成反比,则![]() =1.4,解得x=0.4,
=1.4,解得x=0.4,
容器的容积为2L,则平衡时,CH4、H2O、CO、H2的浓度分别为:0.3mol/L、0.3mol/L、0.2mol/L、0.6mol/L,
则该反应的平衡常数为K=![]() =
=![]() =0.48。
=0.48。
因此,本题正确答案是:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+204kJ/mol;>;0.48;
(4)由图示已知吸收池中用的是K2CO3溶液,吸收CO2,则离子方程式是CO32-+CO2+H2O=2HCO3-,
因此,本题正确答案是:CO32-+CO2+H2O=2HCO3-。


科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸。20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100molL﹣1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
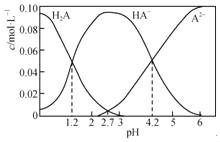
A. H2A的Ka1=10﹣1.2
B. pH=4.2的溶液中:c(HA﹣)=c(A2﹣)=0.050 molL﹣1
C. pH=7的溶液中:c(Na+)>2c(A2﹣)+c(H+)
D. c(Na+)=0.150 molL﹣1的溶液中:2c(OH﹣)+c(HA﹣)+3c(H2A)=2c(H+)+c(A2﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列转化过程的化学方程式。单质、氧化物、酸、碱和盐的相互关系,可以用下图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
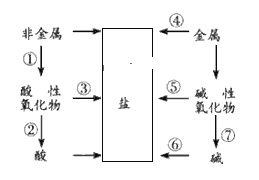
①______,②_______,③_______,④________,⑤____,⑥_______,⑦______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是
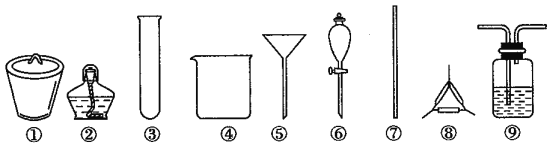
A. 制取氨气,可选用②③
B. 分离 NaHCO3,可选用④⑤⑦
C. 制取 Na2CO3,可选用①②⑦⑧
D. 制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为H2与O2反应生成H2O(g)的能量变化示意图:

下列有关叙述不正确的是
A. 1molH2分子断键需要吸收436kJ的能量
B. H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8kJ/mol
C. 分解1mol气态水生成氢气和氧气总共需要吸收926.8kJ的热量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为________________________________。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因__________________________________________。
II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
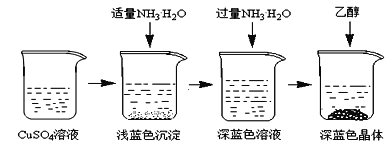
(3)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式___________________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是________________________。
III.氨含量的测定
精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
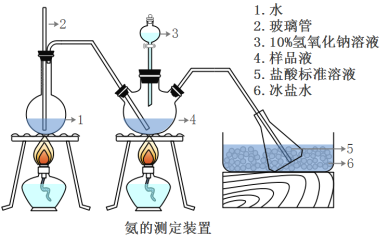
(5)A装置中长玻璃管的作用_________________,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏高的原因是____________________。
A.滴定时未用NaOH标准溶液润洗滴定管。
B.读数时,滴定前平视,滴定后俯视。
C.滴定过程中选用酚酞作指示剂。
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,含有相同氧原子数的![]() 与CO气体,下列叙述正确的( )
与CO气体,下列叙述正确的( )
A.物质的量之比为2:1B.体积之比为1:2
C.质量之比为16:7D.密度之比为7:16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1二元酸H2A溶液中滴加0.2 mol·L-l NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是( )
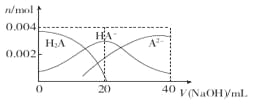
A. 当V(NaOH)="20" mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c( A2-)>c( OH-)> ((H+)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大
C. 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D. 当V(NaOH) ="40" mL时,升高温度,c(Na+)/c(A2-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
B. 标准状况下,2.24 L乙烷和丙烯的混合物中含氢原子数目为0.6NA
C. 将0.1 mol H2和0.2 mol I2(g)充入密闭容器中充分反应后,生成的H-I键数目为0.2NA
D. 常温下,电解1 L的精制食盐水,一段时间后测得溶液pH为11,则电解过程中通过导线的电子数目为0.002NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com