
【题目】H2A为二元弱酸。20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100molL﹣1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
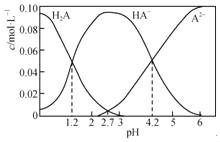
A. H2A的Ka1=10﹣1.2
B. pH=4.2的溶液中:c(HA﹣)=c(A2﹣)=0.050 molL﹣1
C. pH=7的溶液中:c(Na+)>2c(A2﹣)+c(H+)
D. c(Na+)=0.150 molL﹣1的溶液中:2c(OH﹣)+c(HA﹣)+3c(H2A)=2c(H+)+c(A2﹣)
【答案】AC
【解析】
A. 根据H2A的第一步电离平衡常数Ka1 = ![]() 作答;
作答;
B. 溶液中存在微弱的电离与水解,c(H2A) ![]() 0;
0;
C. 结合H2A的第二步电离平衡常数Ka2及电荷守恒规律分析作答;
D. 根据电荷守恒与物料守恒作答。
A. 从图中可看出,当pH = 1.2时,c(H2A) = c(HA-),则H2A的Ka1=![]() = 10-pH = 10-1.2,故A项正确;
= 10-pH = 10-1.2,故A项正确;
B. 从图中可看出,在pH=4.2的溶液中:c(HA-)=c(A2-),因有少许H2A图中未显示,结合题设条件c(H2A)+c(HA-)+c(A2-)=0.100 mol·L-1,则c(HA-)等于c(A2-)略小于0.050 mol/L,故B项错误;
C.其中在pH=4.2时,可计算出二元弱酸H2A的第二步电离平衡常数 = ![]() = 10-4.2在pH=7的溶液c(A2-)接近0.1 mol/L,c(H+)=10-7 mol/L,带入上述平衡常数表达式可得c(HA-) = 10-3.8> c(H+),根据电荷守恒规律又知c(Na+)=2c(A2-)+c(HA-),则c(Na+)>2c(A2-)+c(H+),故C项正确;
= 10-4.2在pH=7的溶液c(A2-)接近0.1 mol/L,c(H+)=10-7 mol/L,带入上述平衡常数表达式可得c(HA-) = 10-3.8> c(H+),根据电荷守恒规律又知c(Na+)=2c(A2-)+c(HA-),则c(Na+)>2c(A2-)+c(H+),故C项正确;
D. c(Na+)=0.150 mol·L-1的溶液中存在c(H2A)+c(HA-)+c(A2-)=0.100molL-1,则溶液中存在物料守恒2c(Na+)=3[c(H2A)+c(HA-)+c(A2-)]①,又存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)②,①-2×①得,2c(OH-)+c(A2-) =c(HA-)+3c(H2A) 2c(H+),故D项错误;
答案选AC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列属于放热反应的是
A. C + CO2![]() 2CO
2CO
B. CaCO3![]() CaO + CO2↑
CaO + CO2↑
C. 2Al + Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
D. Ba(OH)2·8H2O + 2NH4Cl=BaCl2 + 2NH3↑+ 10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,向A中充入一定量H2、O2的混合气体,向B中充入1mol空气,此时活塞的位置如图所示。

(1)A室混合气体的物质的量为_______。
(2)实验测得A室混合气体的质量为34g,A室中含氧气_______mol;该混合气体的密度是同温同压时H2密度的 _______倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留在_____刻度处,容器内气体压强与反应前气体压强之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合题
Ⅰ.现有失去标签的CaCl2、AgNO3、HCl和Na2CO3四瓶溶液。为了确定这四瓶溶液成分,将四瓶溶液成分别编号为A、B、C、D后进行化学实验,实验记录如下:
实验顺序 | 实验内容 | 实验现象 |
① | A+B | 无现象 |
② | B+D | 有气体放出 |
③ | C+B | 有沉淀生成 |
④ | A+D | 有沉淀生成 |
请根据上述实验填空:
(1)A、C两瓶溶液分别是(用化学式表示)_____、______。
(2)A、D溶液混合恰好完全反应生成白色沉淀,过滤、洗涤,再向滤渣中加入足量盐酸溶液,写出向滤渣中加人盐酸的离子方程式: ______。
Ⅱ.某固体混合物中,可能含有下列离子中的几种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-,将该混合物溶于水后得到澄清溶液,现取三份各100mL该溶液分别进行如下实验(已知:NH4++OH-NH3↑+H2O)。
(1)在一份溶液中加入AgNO3溶液,有白色沉淀生成。
(2)在另一份溶液中加入足量的NaOH 溶液并加热,收集到1.12L气体(标准状况下)。
(3)在第三份溶液中加入足量的BaCl2溶液后有沉淀生成,经称量其质量为6.27g,在该沉淀中加入足量的盐酸,沉淀部分溶解,剩余固体质量为2.33g。根据上述实验回答下列问题:
①溶液中一定不存在的离子是_______。
②溶液中一定存在的阴离子有______,其物质的量浓度分别为______ 。
③推断 K+是否存在并说理由:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算:
(1)用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为____mol·L-1。
(2)若从中取出50mL,其物质的量浓度为____mol·L-1;溶质的质量为___g。
(3)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为____mol·L-1,SO42-的物质的量浓度为_____mol·L-1。
(4)已知:a g某气体A含有b个分子,则c g该气体在标准状况下的体积为____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中发生反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法正确的是( )

A. 323 K时,缩小容器体积可提高SiHCl3的转化率
B. a、b点对应的反应速率大小关系:v(a)<v(b)
C. 343 K时,上述反应的化学平衡常数约为0.02
D. 2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)的正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
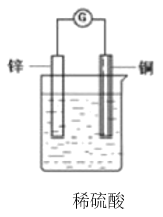
【题目】把一块锌片和一块铜片平行地插入盛有稀硫酸溶液的烧杯中,观察到的现象是________,再用导线把锌片和铜片连接起来,在导线中间接入灵敏电流计,灵敏电流计上观察到的现象是________;该原电池中电子流动的方向是________,总反应的化学方程式是________,其中________元素被氧化,________极上发生还原反应;在上述化学方程式上方用单线桥标出电子转移的方向和数目。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2加氢合成甲醇是合理利用CO2的有效途径。由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅰ、Ⅱ、Ⅲ的化学平衡常数分别为K1、K2、K3、则K3=__________(用K的代数式表示)
(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图 1 所示。

①比较 T1 与 T2 的大小关系:T1____________T2(填“<”、“=”或“>”)
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为________。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图 2所示(3~4 min 的浓度变化未表示出来),则改变的条件为 __________,请用 H2 的浓度变化计算从4 min开始到 A点的反应速率v(H2)= _________(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_______L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
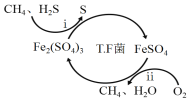
(1)过程i的离子反应方程式为_________________________________________。
(2)已知:
①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是_______<pH<_______,这样选择的原因是:_______________________________________________。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
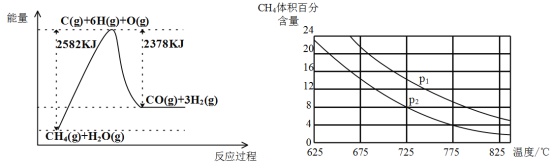
(3)①该过程的热化学方程式是__________________________________________。
②比较压强P1和p2的大小关系:P1 _________ P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1molCH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________(结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
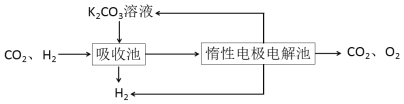
(4)吸收池中发生反应的离子方程式是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com