
【题目】下列属于放热反应的是
A. C + CO2![]() 2CO
2CO
B. CaCO3![]() CaO + CO2↑
CaO + CO2↑
C. 2Al + Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
D. Ba(OH)2·8H2O + 2NH4Cl=BaCl2 + 2NH3↑+ 10H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫的化合物在化工生产、污水处理等领域应用广泛。
Ⅰ.羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、大气污染等。羰基硫的水解和氢解是两种常用的脱硫方法,其反应式分别为:
a.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-35 kJ/mol
H2S(g)+CO2(g) △H1=-35 kJ/mol
b.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3=-42kJ/mol
H2(g)+CO2(g) △H3=-42kJ/mol
(1)完成上述氢解反应的热化学方程式:______。
(2)一定条件下,密闭容器中发生反应a,其中COS(g)的平衡转化率(α)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是______(填字母)。

(3)反应b的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(K正)的是______(填“A”或“B”)。

(4)T1℃时,向容积为10L的恒容密闭容器中充入2molCOS(g)和2molH2(g),发生反应b,则:COS的平衡转化率为______。
Ⅱ.矿石冶炼与含硫化合物有关。
(5)将冰铜矿(主要为Cu2S和FeS相熔合而成)加熔剂(石英砂)在1200℃左右吹入空气进行吹炼:Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程中发生反应的化学方程式分别是:___________;___________。
(6)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性。
①吸收Cl2后的溶液中一定存在的阴离子有OH-、______。
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液。此实验不能证明溶液中含有SO32-,理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. 氯化氢的电子式:![]() B. 镁的原子结构示意图:
B. 镁的原子结构示意图:![]()
C. 乙烯的结构简式:CH2CH2 D. 碳酸钠的电离方程式:Na2CO3=Na++CO32一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子,其M层与K层电子数相同;元素Y的原子,其L层上有5个电子。X和Y所形成的稳定化合物的式量为( )
A. 100B. 90C. 88D. 80
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析不正确的是
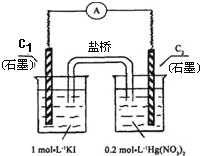
A. 如图装置的电流方向是从C2到C1
B. C1附近加入淀粉变蓝,C2析出固体
C. 可用饱和KI溶液—琼脂填充盐桥增强导电性
D. 该装置内发生的氧化还原反应可自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. 用四氯乙烯干洗剂除去衣服上油污,发生的是物理变化
B. “碳九”(石油炼制中获取的九个碳原子的芳烃)均属于苯的同系物
C. 维生素C是NaNO2中毒的急救药之一,利用了维生素C的还原性
D. 波尔多液(硫酸铜、石灰和水配成)用作农药,利用Cu2+使病毒蛋白变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) ΔH<0,下列结论中不正确的是
pC(g)+qD(g) ΔH<0,下列结论中不正确的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D. 若温度不变时,在恒容条件下充入稀有气体增大压强,该反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸。20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100molL﹣1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
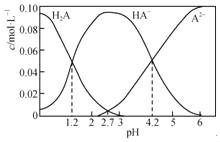
A. H2A的Ka1=10﹣1.2
B. pH=4.2的溶液中:c(HA﹣)=c(A2﹣)=0.050 molL﹣1
C. pH=7的溶液中:c(Na+)>2c(A2﹣)+c(H+)
D. c(Na+)=0.150 molL﹣1的溶液中:2c(OH﹣)+c(HA﹣)+3c(H2A)=2c(H+)+c(A2﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com